
| 1000ρω |
| M |
| 1000ρω |
| M |
| 1000×1.2×40% |
| 40 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、用物质A表示的反应的平均速率为0.3 mol?L-1?s-1 |
| B、用物质B表示的反应的平均速率为0.6 mol?L-1?s-1 |
| C、2 s时物质A的转化率为70% |
| D、2 s时物质B的浓度为0.3 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、安静状态下,长时间太快且太深的呼吸可以使呼出的气体中CO2的体积分数大于5% |
| B、人在痛苦中,长时间太深的呼吸可导致血液PH降低 |
| C、人在安静状态下,长时间太浅的呼吸可以导致血液PH降低 |
| D、窒息而死的人血液PH高于7.45 |
查看答案和解析>>
科目:高中化学 来源: 题型:
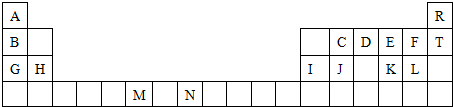
 所示,该晶胞中含有金属原子的数目为
所示,该晶胞中含有金属原子的数目为查看答案和解析>>
科目:高中化学 来源: 题型:
| 引燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com