
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________。
(2)下列关于CH4和CO2的说法正确的是_______________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”

分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_______________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________。
【答案】H<C<O ad 氢键、范德华力 二氧化碳的分子直径小于笼状结构的空腔直径,而且CO2与水分子之间可形成氢键,CH4与水分子之间不能形成氢键,CO2结合水分子能力大于CH4
【解析】
(1)元素的非金属性越强,其电负性越大;
(2)依据二氧化碳和甲烷的结构以及性质回答;
(3)①可燃冰中存在水分子,水分子中存在分子间作用力和氢键;
②依据表格得出二氧化碳的分子直径小于0.586nm,且与水的结合能力为29.91大于16.40,据此解答即可。
(1)元素的非金属性越强,其电负性就越大;在CH4和CO2所含的H、C、O三种元素中,元素的非金属性由强到弱的顺序是O>C>H,所以元素的电负性从小到大的顺序为H<C<O;
(2) a.固态CO2是由CO2分子通过分子间作用力结合形成的分子晶体,故a正确;
b.在CH4分子中含有不同种非金属元素形成的C—H极性共价键,由于该分子是正四面体型的结构的分子,分子中正负电中心重合,因此该反应是非极性分子,故b错误;
c.CH4和CO2都是由分子构成的分子晶体,分子之间通过分子间作用力结合,分子间作用力越强,物质的熔、沸点就越高,物质的熔沸点高低与分子内的化学键的强弱无关,故c错误;
d.CH4分子中碳原子的价层电子对数为4+![]() ×(4-4×1)=4,碳原子的杂化类型是sp3杂化,CO2分子中C原子的价层电子对数为2+
×(4-4×1)=4,碳原子的杂化类型是sp3杂化,CO2分子中C原子的价层电子对数为2+![]() ×(4-2×2)=2,碳原子的杂化类型是sp杂化,故d正确;
×(4-2×2)=2,碳原子的杂化类型是sp杂化,故d正确;
故答案选ad;
(3)①“可燃冰”中分子间存在的2种作用力是范德华力和氢键;
②据表格数据可知,笼状空腔的直径(0.586nm)大于CO2分子的直径(0.512nm),而且CO2与水分子之间可形成氢键,CH4与水分子之间不能形成氢键,CO2结合水分子能力大于CH4,因此可以实现用CO2置换CH4的设想。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
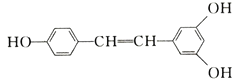
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在指定条件下电离方程式正确的是( )
A. Na2CO3溶于水:Na2CO3===Na22++CO32-
B. Al(OH)3酸式电离:Al(OH)3===AlO2-+H2O+H+
C. NaHS溶于水HS-的电离:HS-+H2O![]() H2S+OH-
H2S+OH-
D. NaHSO4加热熔化:NaHSO4===Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数目为0.1NA
B.质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA
C.1.0 mol Na2O2和1.0 mol Na2S混合后阴离子总数为2NA
D.60 g SiO2晶体中,含有SiO4四面体结构单元的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)![]() 2SO2(g)+ O2(g)。下列有关说法正确的是
2SO2(g)+ O2(g)。下列有关说法正确的是
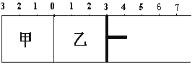
A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲
B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲
C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲
D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2molA气体和2molB气体后发生如下反应:![]() ,反应达到平衡状态时生成1molC气体,放出热量
,反应达到平衡状态时生成1molC气体,放出热量![]() ;乙中加入1molC气体,反应达到平衡时,吸收热量
;乙中加入1molC气体,反应达到平衡时,吸收热量![]() ,则
,则![]() 与
与![]() 的相互关系正确的是( )
的相互关系正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法错误的是
A. 12.5mL 16mol/L浓硫酸与足量锌充分反应,转移电子数为0.2NA
B. 5.8g熟石膏(2CaSO4 H2O)含有的结晶水分子数为0.02NA
C. 92.0g甘油(丙三醇)和甲苯的混合物中含氢原子数为8.0NA
D. 标准状况下,1L甲醛气体完全燃烧消耗O2分子个数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、![]() 、
、![]()
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、![]() 、
、![]()
C.0.1mol/LNH4HCO3溶液中:K+、Na+、![]() 、Cl-
、Cl-
D.0.1mol/LFeCl3溶液中:Na+、![]() 、S2-、
、S2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有足量A的容积固定的密闭容器中加入B,发生反应:A(s)+2B(g) 4C(g)+D(g) ΔH<0。一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示。其他条件不变,下列措施能使θ值增大的是( )

A. 降低温度B. 增大压强C. 加入催化剂D. 再加入少量A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com