
【题目】设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数目为0.1NA
B.质量均为1.7 g的OH-和—OH,所含质子数目均为0.9NA
C.1.0 mol Na2O2和1.0 mol Na2S混合后阴离子总数为2NA
D.60 g SiO2晶体中,含有SiO4四面体结构单元的数目为NA
【答案】A
【解析】
A.由于NH4Cl溶液中存在NH4+的水解,所以1 L 0.1 mol·L-1 NH4Cl溶液中NH4+的数目小于0.1NA,故A错误;
B.电子质量忽略不计,质量均为1.7 g的OH-和-OH的物质的量均为0.1mol,OH-和-OH都含9个质子,所含质子数目均为0.9NA,故B正确;
C. Na2O2 中的阴离子是O22-,1.0 mol Na2O2 中含有1.0 mol过氧根离子,1.0 mol Na2O2和1.0 mol Na2S 混合后阴离子总数为2NA,故C正确;
D.n(SiO2)=![]() =1 mol,每个Si原子和四个O原子形成四面体结构,所以60 g SiO2晶体中Si原子个数为NA,所含SiO4四面体数为NA,故D正确;
=1 mol,每个Si原子和四个O原子形成四面体结构,所以60 g SiO2晶体中Si原子个数为NA,所含SiO4四面体数为NA,故D正确;
选A。


科目:高中化学 来源: 题型:
【题目】由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝,工艺流程如下:
(已知:NaCl熔点为801℃;AlCl3在181℃升华;固体直接变为气体叫做升华)

(1)把NaCl和AlCl3的固体混合物置于下图所示的装置的一端,加热到_______(最低温度)℃,即可分离NaCl和AlCl3
![]()
(2)将Cl2连续通入坩埚中的粗铝熔体里,杂质随气泡上浮除去气泡的主要成分除Cl2外还含有_______;固态杂质黏附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在的物质是_______
(3)用废碱液处理气体A的过程中,所发生反应的离子方程式有:
①H++OH![]() H2O,
H2O,
②________
(4)镀铝电镀池中,金属铝为____极,熔融盐电镀池中存在Na+K+AlCl4-Al2Cl7-等离子钢材表面(电极)的电极反应式为AlCl4-+3e-![]() Al+4Cl-或_________
Al+4Cl-或_________
(5)钢材镀铝后,在表面氧化成致密的_____________,避免钢材接触空气而防止钢材被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )
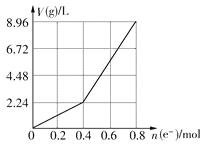
A.电解前CuSO4溶液的物质的量浓度为2 mol/L
B.电解后所得溶液中c(H+)=2 mol/L
C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3
D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为
,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为![]() ;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为
;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为![]() ,已知
,已知![]() 下列叙述正确的是
下列叙述正确的是![]()
A.甲中反应达到平衡时,![]()
B.达到平衡后,甲中C的体积分数比乙大
C.达到平衡后,再向乙中加入![]() 、
、![]() 、
、![]() ,平衡向生成C的方向移动
,平衡向生成C的方向移动
D.乙中的热化学反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究苯和溴的取代反应,并制取少量溴苯。
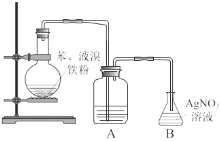
已知:溴单质易挥发,微溶于水,易溶于四氯化碳等有机溶剂;溴苯密度为 1.5 g·cm-3
(1)装置 A 中盛放的试剂是______________(填字母)。
A.浓硫酸 B.氢氧化钠溶液 C.硝酸银溶液 D.四氯化碳
(2)证明苯与溴发生取代反应,预期应观察到 B 中的现象是____________。
(3)反应后,将烧瓶中的红褐色油状液体进行提纯,步骤如下:
①用 NaOH 溶液多次洗涤有机层至无色,得粗溴苯。NaOH 溶液的作用是_____________。
②向粗溴苯中加入无水氯化钙进行干燥,静置、过滤,得滤液。
③滤液中仍含有少量苯,经_______________(填操作名称)得溴苯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于化学反应的研究结论正确的是
A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应,则该反应是吸热反应
B.溶液中的离子反应的活化能很高
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________。
(2)下列关于CH4和CO2的说法正确的是_______________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”

分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_______________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 molL-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是
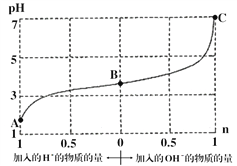
A. A、B、C三点所表示的溶液中水的电离程度依次增大
B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-)
C. 通入HCl, R-的水解程度增大,HR的电离常数减小
D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com