
【题目】现有容积为1L的甲乙两个恒温恒容密闭容器,向甲中加入2molA气体和2molB气体后发生如下反应:![]() ,反应达到平衡状态时生成1molC气体,放出热量
,反应达到平衡状态时生成1molC气体,放出热量![]() ;乙中加入1molC气体,反应达到平衡时,吸收热量
;乙中加入1molC气体,反应达到平衡时,吸收热量![]() ,则
,则![]() 与
与![]() 的相互关系正确的是( )
的相互关系正确的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
【答案】C
【解析】
根据加入1molA气体和1molB气体与加入1molC气体是在保持恒温、恒容情况下是等效平衡,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,增大压强,反应向体积缩小的方向正向移动来分析。
反应达到平衡状态,生成1molC气体,放出热量Q1kJ,则Q1=a;A(g)+B(g)C(g)该反应为可逆反应,从起始量分析,正向反应是放热反应,逆向进行的反应是吸热反应,正反应是体积缩小的反应;根据等效平衡可知:保持容器温度和容积不变,加入1molA气体和1molB气体与加入1molC气体是等效的,则Q2+Q3=a=Q1,又知保持容器温度和容积不变,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,A(g)+B(g)C(g)从起始量分析,正反应是体积缩小的反应,增大压强,反应向体积缩小的方向移动,所以平衡正向移动,所以放出的热量Q1>2Q3,所以Q1+2Q2>2a,所以选C。故选C。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】图中的曲线是表示其他条件一定时,2NO(g)+O2(g)2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为
,有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molA和3molB,在一定条件下达到平衡时放出热量为![]() ;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为
;在相同条件下,向乙容器中加入2molC达到平衡后吸收热量为![]() ,已知
,已知![]() 下列叙述正确的是
下列叙述正确的是![]()
A.甲中反应达到平衡时,![]()
B.达到平衡后,甲中C的体积分数比乙大
C.达到平衡后,再向乙中加入![]() 、
、![]() 、
、![]() ,平衡向生成C的方向移动
,平衡向生成C的方向移动
D.乙中的热化学反应方程式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于化学反应的研究结论正确的是
A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应,则该反应是吸热反应
B.溶液中的离子反应的活化能很高
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________________。
(2)下列关于CH4和CO2的说法正确的是_______________(填序号)。
a.固态CO2属于分子晶体
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”

分子 | 分子直径 | 分子与H2O 的结合能E(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的2种作用力是_______________________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_____。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______(填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
________Br2+________![]() =________
=________![]() +_Br-+_CO2↑
+_Br-+_CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:______。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是______(填字母)。
A.稀硫酸 B.四氯化碳 C.烧碱溶液 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2l恒温恒容容器中加入2molMgSO4并充入 2molCO,发生反应:MgSO4(s)+ CO(g)![]() MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H > 0 。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

A. 0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1 ·min-1
B. 2 ~4min内容器内气体的密度没有变化
C. 该温度下,反应的平衡常数为1.8
D. 保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)> 0.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是

A. 石墨电极上发生氧化反应 B. 通甲烷的电极反应式:CH4+4CO32--8e-=5CO2+2H2O
C. 通空气的电极反应式为O2+4e-=2O2- D. 甲烷燃料电池中CO32-向空气一极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。
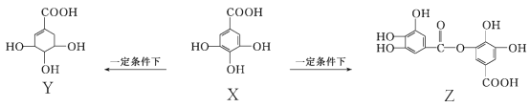
下列说法错误的是
A. 1 mol Z最多能与8 mol NaOH发生反应
B. 1 mol X与H2完全加成产物的分子式为C7H12O5
C. 向Y中滴加FeCl3溶液呈紫色
D. 1 mol Y与足量的金属钠反应放出2 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com