
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
___________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。

【答案】NO2-发生水解反应NO2-+H2O![]() HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深 还原性 N原子最外层5个电子(可用原子结构示意图表示),+3价不稳定,易失电子,体现还原性 浅绿色 棕色 0.5mol·L1Fe2(SO4)3溶液(pH=3) 棕色溶液中的[Fe(NO)]2+受热生成NO和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀 阻碍Fe2+与NO接触,避免络合反应发生 Fe2+ +NO2-+2H+= Fe3+ +NO↑+H2O
HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深 还原性 N原子最外层5个电子(可用原子结构示意图表示),+3价不稳定,易失电子,体现还原性 浅绿色 棕色 0.5mol·L1Fe2(SO4)3溶液(pH=3) 棕色溶液中的[Fe(NO)]2+受热生成NO和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀 阻碍Fe2+与NO接触,避免络合反应发生 Fe2+ +NO2-+2H+= Fe3+ +NO↑+H2O
【解析】
(1)根据实验I的现象说明NaNO2为强碱弱酸盐,NO2-发生水解反应NO2-+H2O![]() HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深;
HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深;
(2)N原子最外层5个电子,NO2-中N为+3价不稳定,易失电子,体现还原性;
(3)①若要证明棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,需要作对照实验,即向pH均为3,含Fe2+和Fe3+浓度均为1mol/L的FeSO4溶液和Fe2(SO4)3溶液中通入NO,若通入FeSO4溶液出现溶液由浅绿色迅速变为棕色,而通入Fe2(SO4)3溶液无现象,则可证明;
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,说明加热后生成了NO气体;溶液中有红褐色沉淀生成,说明生成了Fe(OH)3,据此解答;
(4)①将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大,由图可知,该装置构成了原电池,两电极分别产生NO和Fe3+,U形管中间盐桥的作用是阻碍Fe2+与NO接触,避免络合反应发生;
②两电极反应式相加得总反应式。
(1)根据实验I的现象说明NaNO2为强碱弱酸盐,NO2-发生水解反应NO2-+H2O![]() HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深,所以在2mL1 mol·L-1 NaNO2溶液中滴加酚酞溶液出现溶液变为浅红色,微热后红色加深,
HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深,所以在2mL1 mol·L-1 NaNO2溶液中滴加酚酞溶液出现溶液变为浅红色,微热后红色加深,
故答案为:NO2-发生水解反应NO2-+H2O![]() HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深;
HNO2+OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深;
(2)根据实验II说明NaNO2溶液与KMnO4 溶液在酸性条件下发生氧化还原反应而使KMnO4 溶液的紫色褪去,即KMnO4被还原,说明NO2-具有还原性。NO2-具有还原性的原因是:N原子最外层5个电子(可用原子结构示意图表示),+3价不稳定,易失电子,体现还原性,
故答案为:还原性;N原子最外层5个电子(可用原子结构示意图表示),+3价不稳定,易失电子,体现还原性;
(3)①实验IV在FeSO4 溶液(pH=3)中滴加NaNO2溶液,溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红,说明有Fe3+生成,NO2-被还原为NO。若要证明棕色物质是是NO与Fe2+,而非Fe3+发生络合反应的产物,需要作对照实验,即向pH均为3,含Fe2+和Fe3+浓度均为1mol/L的FeSO4溶液和Fe2(SO4)3溶液中通入NO,若通入FeSO4溶液出现溶液由浅绿色迅速变为棕色,而通入Fe2(SO4)3溶液无现象,则可证明;
故答案为:浅绿色;棕色;0.5mol·L1Fe2(SO4)3溶液(pH=3);
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,说明加热后生成了NO气体;溶液中有红褐色沉淀生成,说明生成了Fe(OH)3,原因是棕色溶液中的[Fe(NO)]2+受热生成NO和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀,
故答案为:棕色溶液中的[Fe(NO)]2+受热生成NOspan>和Fe2+,NO被空气氧化为NO2,加热有利于Fe2+被氧化为Fe3+,促进Fe3+水解,产生Fe(OH)3沉淀;
(4)①将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大,由图可知,该装置构成了原电池,两电极分别产生NO和Fe3+,U形管中间盐桥的作用是阻碍Fe2+与NO接触,避免络合反应发生;
故答案为:阻碍Fe2+与NO接触,避免络合反应发生;
②该原电池负极反应为:Fe2+-e-= Fe3+,正极反应为NO2-+e-+2H+=NO↑+H2O,所以电池总反应式为Fe2+ +NO2-+2H+= Fe3+ +NO↑+H2O;
故答案为:Fe2+ +NO2-+2H+= Fe3+ +NO↑+H2O。


科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。以铅泥(PbSO4、PbO、Pb及其他杂质等)为原料制备三盐的工艺流程如下图所示
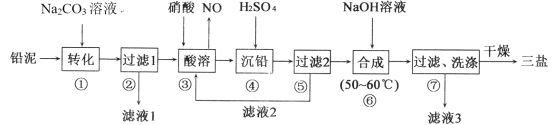
已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的主要离子方程式_______。
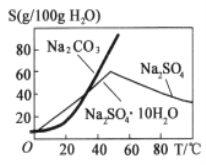
(2)根据图溶解度曲线,由滤液I得到Na2SO4固体的操作为:将“滤液1”________、______、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是____________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为___(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=____mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为___________。
(6)若消耗100 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75.0%转化为三盐,则铅泥中铅元素的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 高压比常压更有利于合成SO3
C. 反应2SO2+O2![]() 2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列实验事实的解释,不合理的是
选项 | 实验事实 | 解释 |
A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
B | 电解CuCl2溶液阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
D | 钠与水反应剧烈;钠与乙醇反应平缓 | 羟基中氢的活泼性:H2O> C2H5OH |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为主要原料,经下列转化可合成高分子材料C和重要的有机合成中间体H(部分反应条件和产物已略去)

已知:R1CH2COOCH3+R2COOCH3 +CH3OH
+CH3OH
请回答下列问题:
(1)A→B的反应类型是___________。
(2)B→C的化学方程式为_________。
(3)D的官能团名称是_________。
(4)E→F的化学方程式为_______。
(5)G的结构简式是_________。
(6)F→G为两步反应,中间产物的结构简式是_______。
(7)芳香化合物M(C8H10O2)与E的水解产物互为同分异构体,1molM可与2 mol NaOH反应,其核磁共振氢谱中有3组峰且峰面积之比为3:1:1,则M的结构简式是_________(写出一种即可)。
(8)以CH3Cl、CH3ONa、NaCN为原料(其它无机试剂任选),结合题目已知信息,写出制备CH3COCH2 COOCH3的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )

A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

(1)“O”点导电能力为0的理由是____________________________
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为__________________________。
(3)a、b、c三点处,电离程度最大的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298 K时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失)
A. 一定小于92.0 kJ B. 一定大于92.0 kJ
C. 一定等于92.0 kJ D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是( )
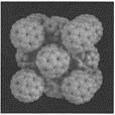
A. C60摩尔质量是720
B. C60与苯互为同素异形体
C. 在C60晶胞中有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com