
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 向K2Cr2O4溶液中滴入浓的NaOH溶液后,溶液黄色加深
B. 高压比常压更有利于合成SO3
C. 反应2SO2+O2![]() 2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
2SO3 ΔH<0,工业上采取高温的措施有利于提高SO2的转化率
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
【答案】C
【解析】
A.在K2Cr2O7溶液中存在如下平衡:Cr2O72-+H2O![]() 2CrO42-+2H+,加入NaOH溶液后平衡正向移动溶液CrO42-浓度增大,黄色加深,能用勒夏特列原理解释,故不选A;
2CrO42-+2H+,加入NaOH溶液后平衡正向移动溶液CrO42-浓度增大,黄色加深,能用勒夏特列原理解释,故不选A;
B. 2SO2+O2![]() 2SO3,正反应为气体体积减小的反应,加压平衡会正向移动,所以高压比常压更有利于合成SO3,能用勒夏特列原理解释,故不选B;
2SO3,正反应为气体体积减小的反应,加压平衡会正向移动,所以高压比常压更有利于合成SO3,能用勒夏特列原理解释,故不选B;
C.反应2SO2+O2![]() 2SO3 ΔH<0,升高温度平衡逆向移动,不利于提高SO2的转化率,所以不能用勒夏特列原理解释工业上采取高温生成SO3,故选C;
2SO3 ΔH<0,升高温度平衡逆向移动,不利于提高SO2的转化率,所以不能用勒夏特列原理解释工业上采取高温生成SO3,故选C;
D.合成氨反应:N2+3H2![]() 2NH3 ΔH<0,正反应为气体体积减小的放热反应,采取低温高压的措施,平衡正向移动,氨的产率提高,能用勒夏特列原理解释,故不选D。
2NH3 ΔH<0,正反应为气体体积减小的放热反应,采取低温高压的措施,平衡正向移动,氨的产率提高,能用勒夏特列原理解释,故不选D。
正确答案:C。


科目:高中化学 来源: 题型:
【题目】NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是__,还原性I-__NO(填“>”或“<”)。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有①水、②碘化钾淀粉试纸、③淀粉、④白酒、⑤食醋,你认为必须选用的物质有__(填序号)。
(3)请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+_H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为__L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为______________________________。
(2)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(3)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_________________________________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8g铁粉加入50mL3mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.Fe2+和Fe3+物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g)![]() CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度b.加入催化剂 c.减小CO2的浓度d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g)![]() CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程图,按照要求回答问题:

(1)海水中碘的总藏量很大,目前工业上___(填“直接”或“不直接”)用海水提取碘。
(2)工业生产过程中通常将干海带粉碎的目的是___。
(3)“滤液”中加入硫酸酸化的离子方程式是___;“氧化”步骤发生反应的离子方程式是___。
(4)生产过程图中“提纯”的方法是___。
(5)下列有关从海带中提取碘的说法错误的是___。
A.“过滤”操作若在实验室进行,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒
B.“碱化”时加入NaOH溶液的主要作用是可溶性有机质在碱性溶液中可形成沉淀
C.现在工业上从海带中提取碘时,也有用离子交换法处理含碘离子的溶液以提高碘的提取率
D.可用淀粉溶液检验“滤液”中的离子是否氧化完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
___________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
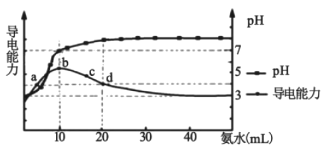
A. 各点溶液中的阳离子浓度总和大小关系:d>c>b>a
B. 常温下,R- 的水解平衡常数数量级为10 -9
C. a点和d点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com