
【题目】实验室用Cl2与KOH溶液反应制备KClO溶液,其装置如下图所示。以KClO溶液及废铁屑等为原料,可制备高效水处理剂聚合硫酸铁![]() 。
。
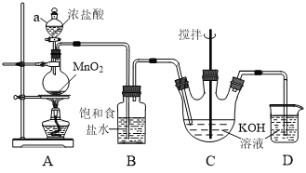
已知:C中反应是放热反应
(1)装置A中仪器a的名称是______;装置B的作用是_______。
(2)Cl2和KOH在较高温度下反应生成KClO3,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_______(回答一点即可)。
(3)装置D发生反应的离子方程式为______。
(4)聚合硫酸铁![]() (其中Fe元素为+3价)的组成可通过下列实验测定:
(其中Fe元素为+3价)的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁溶于稀盐酸中,往所得溶液中滴加BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体11.65 g;
②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250.00 mL溶液B;
③准确量取25.00 mL溶液B,用0.1000 mol·L-1的KMnO4溶液滴定至终点,消耗KMnO4溶液8.00 mL。该步反应为:![]() 。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
。通过计算确定该聚合硫酸铁的化学式(写出计算过程)。______。
【答案】分液漏斗 除去Cl2中的HCl气体 将装置D置于0℃~5℃的水浴中(控制滴加速度等) Cl2+2OH-=Cl-+ClO-+H2O 250.00mL溶液中:n(SO42)=n(BaSO4)=![]() =0.0500mol
=0.0500mol
根据:5Fe3+5Fe2+MnO4-
n(Fe3+)=5n(MnO4-)=5×0.1000molL1×8.00mL×103LmL1×![]() =0.0400mol
=0.0400mol
由电荷守恒:3n(Fe3+)=2n(SO42)+n(OH)
n(OH)=3n(Fe3+)2n(SO42)=3×0.0400mol2×0.0500mol=0.0200mol
n(Fe3+):n(OH):n(SO42)=0.0400mol:0.0200mol:0.0500mol=4:2:5
即聚合硫酸铁的化学式为Fe4(OH)2(SO4)5
【解析】
(1)仪器a为分液漏斗;装置C的作用是制备KClO,其反应原理是2KOH+Cl2=KClO+KCl+H2O,若通入的气体中含有HCl,将会导致制备出的KClO纯度降低,因此装置B的作用是除去Cl2中的HCl气体;
(2)因装置C中反应式放热反应,若于常温下反应,将会有副反应发生生成KClO3,因此需要将装置C中的反应温度控制在0℃~5℃进行,可采取将装置D置于0℃~5℃的水浴中或控制滴加速度使反应放热量减小;
(3)装置D的作用是除去未反应完全的Cl2,防止污染空气,故装置D中发生的反应为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)①步骤中产生的白色沉淀为BaSO4,根据沉淀质量可计算出该质量的聚合硫酸铁中含有的SO42-的量;
②步骤中加入铜粉,发生反应2Fe3++Cu=2Fe2++Cu2+;
③步骤目的是测定25mL溶液B中所含Fe2+的量,然后计算出250mL溶液B中Fe2+的量,由此计算Fe3+的量,然后根据化合物化合价为0计算出OH-的量,由此确定聚合硫酸铁的化学式;其具体计算过程如下:
250.00mL溶液中:n(SO42)=n(BaSO4)=![]() =0.0500mol,
=0.0500mol,
根据:5Fe3+5Fe2+MnO4-,
n(Fe3+)=5n(MnO4-)=5×0.1000molL1×8.00mL×103LmL1×![]() =0.0400mol,
=0.0400mol,
由电荷守恒:3n(Fe3+)=2n(SO42)+n(OH),
n(OH)=3n(Fe3+)2n(SO42)=3×0.0400mol2×0.0500mol=0.0200mol,
n(Fe3+):n(OH):n(SO42)=0.0400mol:0.0200mol:0.0500mol=4:2:5,
即聚合硫酸铁的化学式为Fe4(OH)2(SO4)5。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学习小组为研究铜与浓、稀HNO3反应的差异,设计了如图所示的实验装置。
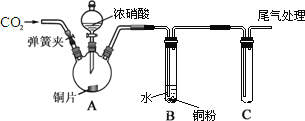
下列说法不正确的是
A. 反应开始前通入过量的CO2气体,目的是排除装置内的空气
B. A中的离子方程式为:Cu+2NO3-+4H+==Cu2++2NO2↑+2H2O
C. 当B中0.03 mol铜粉被氧化时,B中产生的NO气体大于0.02 mol
D. C装置中装入一定量的水进行尾气处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论不正确的是( )
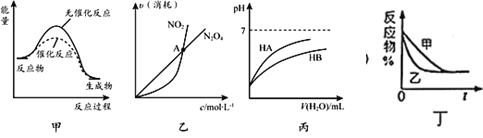
A.由甲可知:使用催化剂不影响反应热
B.由乙可知:对于恒温恒容条件下的反应![]() ,A点为平衡状态
,A点为平衡状态
C.由丙可知:等浓度的HA溶液和HB溶液,其pH前者小于后者
D.图丁表示压强对可逆反应![]() 的影响(横坐标代表时间),乙的压强比甲的压强大
的影响(横坐标代表时间),乙的压强比甲的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某干电池的工作原理如图所示,总反应为:![]() ,下列说法正确的是
,下列说法正确的是
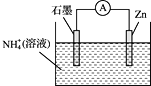
A.石墨为电池的负极
B.电池工作时![]() 被氧化
被氧化
C.实现了电能向化学能转化
D.电子由Zn电极经外电路流向石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN-
B. ![]() =106的溶液中:NH4+、K+、AlO2-、NO3-
=106的溶液中:NH4+、K+、AlO2-、NO3-
C. 能使甲基橙变红的溶液中:Cu2+、Mg2+、SO42-、Cl-
D. 1.0mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于合成材料的说法中,错误的是
A.聚氯乙烯可制成薄膜、软管等,其单体是CH2=CHCl
B.锦纶![]() 的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
的单体是H2N(CH2)6NH2和HOOC(CH2)4COOH
C.合成酚醛树脂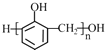 的单体是苯酚和甲醇
的单体是苯酚和甲醇
D.合成顺丁橡胶![]() 的单体是CH2=CH﹣CH=CH2
的单体是CH2=CH﹣CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然氨基酸M是人体必需的氨基酸之一,其合成路线如下:

已知:
①![]()
![]()
② +R—X→
+R—X→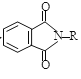 +KX
+KX
(1)A→B的反应条件和试剂是__________________;
(2)I→J的反应类型是______________;
(3)写出G与NaOH水溶液反应的化学方程式________________________________;
(4)化合物M缩聚生成高分子化合物N化学方程式___________;
(5)符合下列条件的化合物M的同分异构体共有__________种(不考虑立体异构);
①含有苯甲酸结构 ②含有一个甲基 ③苯环上只有2个取代基
其中核磁共振氢谱峰面积比为1:1:2:2:2:3的分子的结构简式________________(任写一种);
(6)请写出以丙酸和上述流程中出现的物质为原料经三步合成丙氨酸(![]() )的路线。________________________________________________________________________________
)的路线。________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。工业上可通过以下反应制得ClO2(提示:下面方程式中的氧元素都为负二价)2KClO3+Na2SO3+H2SO4![]() 2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
2ClO2↑+K2SO4+Na2SO4+H2O,则下列说法中正确的是
A. KClO3在反应中是还原剂
B. 制得1mol的ClO2反应中需转移2mol电子
C. Na2SO3的还原性小于ClO2的还原性
D. 反应中被氧化的元素是S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com