
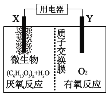
ЁОЬтФПЁПAЁЋIЗжБ№БэЪОжабЇЛЏбЇжаГЃМћЕФвЛжжЮяжЪЃЌЫќУЧжЎМфЯрЛЅЙиЯЕШчЯТЭМЫљЪО(ВПЗжЗДгІЮяЁЂЩњГЩЮяУЛгаСаГі)ЁЃвбжЊHЮЊЙЬЬЌбѕЛЏЮяЃЌFЪЧКьКжЩЋФбШмгкЫЎЕФГСЕэЃЌЧвAЁЂBЁЂCЁЂDЁЂEЁЂFСљжжЮяжЪжаОљКЌЭЌвЛжждЊЫиЁЃ
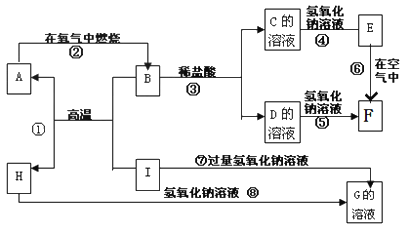
ЧыЬюаДЯТСаПеАзЃК
ЃЈ1ЃЉBЕФЫзГЦ_______ЃЌЗДгІЂйЕФгУЭО_____ЃЈЬювЛЯюЃЉЁЃ
ЃЈ2ЃЉЗДгІЂйЕФЛЏбЇЗНГЬЪНЮЊ________ЁЃЗДгІЂлЕФРызгЗНГЬЪНЮЊ_________ЁЃЗДгІЂрЕФЛЏбЇЗНГЬЪНЮЊ______ЁЃ
ЃЈ3ЃЉЗДгІЂоЕФЛЏбЇЗНГЬЪНМАБфЛЏЙ§ГЬжаЕФЯжЯѓЪЧ__________ЁЃ
ЃЈ4ЃЉЯђGШмвКжаМгШыAlCl3ШмвКЕФРызгЗНГЬЪН____________ЁЃ
ЁОД№АИЁПДХадбѕЛЏЬњ КИНгИжЙьЃЈЛђвБСЖН№ЪєЬњЃЉ 8Al+3Fe3O4![]() 4Al2O3+9Fe Fe3O4+8H+=Fe2++2Fe3++4H2O Al2O3+2NaOH=2NaAlO2+H2O АзЩЋГСЕэбИЫйБфГЩЛвТЬЩЋЃЌзюжеБфГЩКьКжЩЋ 3AlO2-+Al3++6H2O==Al(OH)3Ё§
4Al2O3+9Fe Fe3O4+8H+=Fe2++2Fe3++4H2O Al2O3+2NaOH=2NaAlO2+H2O АзЩЋГСЕэбИЫйБфГЩЛвТЬЩЋЃЌзюжеБфГЩКьКжЩЋ 3AlO2-+Al3++6H2O==Al(OH)3Ё§
ЁОНтЮіЁП
FЪЧКьКжЩЋФбШмгкЫЎЕФГСЕэЃЌЫЕУїFЮЊFe(OH)3ЃЌEдкПеЦјжаПЩзЊБфЮЊFe(OH)3ЃЌЫЕУїEЮЊFe(OH)2ЃЌEгыFЪЧBгыбЮЫсЗДгІЩњГЩЕФCКЭDдйгыNaOHЗДгІЕУЕНЃЌвђДЫCЮЊFeCl2ЃЌDЮЊFeCl3ЃЌBЮЊFe3O4ЃЌAдкбѕЦјжаШМЩеЩњГЩFe3O4ЃЌФЧУДAЮЊFe,BКЭIИпЮТЯТЗДгІЩњГЩЕЅжЪЬњЃЌЫЕУїЗЂЩњЕФЪЧТСШШЗДгІЃЌМДHЮЊAl2O3ЃЌIЮЊAlЃЌ Al2O3гыAlгыЙ§СПЕФЧтбѕЛЏФЦШмвКЗДгІЩњГЩGЃЌФЧУДGЮЊNaAlO2ЃЌОнДЫЗжЮізїД№ЁЃ
ЃЈ1ЃЉBЮЊFe3O4ЃЌЫзУћЮЊДХадбѕЛЏЬњЃЌЗДгІЂйгУгкКИНгИжЙьЛђвБСЖН№ЪєЬњЃЛ
ЃЈ2ЃЉЗДгІЂйЮЊТСШШЗДгІЃЌЗДгІЗНГЬЪНЮЊ8Al+3Fe3O4![]() 4Al2O3+9FeЃЛЗДгІЂлЮЊFe3O4гыЯЁбЮЫсЗДгІЩњГЩТШЛЏЬњЁЂТШЛЏбЧЬњКЭЫЎЕФЗДгІЃЌРызгЗНГЬЪНЮЊЃКFe3O4+8H+=Fe2++2Fe3++4H2OЃЛЗДгІЂрЮЊAl2O3гыNaOHШмвКЗДгІЩњГЩЦЋТСЫсФЦЕФЗДгІЃЌЗНГЬЪНЮЊЃКAl2O3+2NaOH=2NaAlO2+H2OЃЛ
4Al2O3+9FeЃЛЗДгІЂлЮЊFe3O4гыЯЁбЮЫсЗДгІЩњГЩТШЛЏЬњЁЂТШЛЏбЧЬњКЭЫЎЕФЗДгІЃЌРызгЗНГЬЪНЮЊЃКFe3O4+8H+=Fe2++2Fe3++4H2OЃЛЗДгІЂрЮЊAl2O3гыNaOHШмвКЗДгІЩњГЩЦЋТСЫсФЦЕФЗДгІЃЌЗНГЬЪНЮЊЃКAl2O3+2NaOH=2NaAlO2+H2OЃЛ
ЃЈ3ЃЉЗДгІЂоЮЊFe(OH)2дкПеЦјжабѕЛЏЕФЗДгІЃЌFe(OH)2ЮЊАзЩЋГСЕэЃЌБЛбѕЛЏКѓбИЫйБфЮЊЛвТЬЩЋЃЌзюжеБфЮЊКьКжЩЋЃЛ
ЃЈ4ЃЉЯђЦЋТСЫсФЦШмвКжаМгШыAlCl3ШмвКЃЌЩњГЩСЫАзЩЋГСЕэЃЌРызгЗДгІЗНГЬЪНЮЊЃК3AlO2-+Al3++6H2O==Al(OH)3Ё§ЁЃ


 УћЪІжИЕМЦкФЉГхДЬОэЯЕСаД№АИ
УћЪІжИЕМЦкФЉГхДЬОэЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮЂЩњЮяШМСЯЕчГиФмНЋЮлЫЎжаЕФввЖўАЗЃЈH2NCH2CH2NH2ЃЉбѕЛЏГЩЛЗОГгбКУЕФЮяжЪЃЌЪОвтЭМШчЭМЫљЪОЃЌaЁЂbОљЮЊЪЏФЋЕчМЋЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
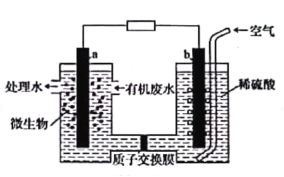
A.aЕчМЋЕФЕчМЋЗДгІЮЊH2NCH2CH2NH2-16e-+4H2O=2CO2Ёќ+N2Ёќ+16H+
B.ЕчГиЙЄзїЪБжЪзгЭЈЙ§НЛЛЛФЄгЩИКМЋЧјЯђе§МЋЧјвЦЖЏ
C.aЕчМЋЩЯЕФЕчЪЦБШbЕчМЋЩЯЕФЕчЪЦЕЭ
D.ЕчГиЙЄзїЪБbЕчМЋИННќШмвКЕФpHБЃГжВЛБф
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
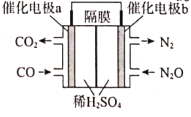
ЁОЬтФПЁПЦћГЕЮВЦјЮлШОЪЧгЩЦћГЕХХЗХЕФЗЯЦјдьГЩЕФЛЗОГЮлШОЁЃжївЊЮлШОЮяЮЊвЛбѕЛЏЬМЁЂЬМЧтЛЏКЯЮяЁЂЕЊбѕЛЏКЯЮяЕШЃЌЖдШЫРрКЭЖЏЁЂжВЮяЮЃКІЩѕДѓЁЃНтОіЦћГЕЮВЦјЮЪЬтЕФжївЊЗНЗЈЪЧбаОПИпаЇДпЛЏМСДйЪЙЮВЦјжаЕФвЛбѕЛЏЬМКЭЕЊбѕЛЏЮяЗДгІЃЌзЊЛЏГЩЮоЮлШОЕФЕЊЦјКЭЖўбѕЛЏЬМЁЃ
ЛиД№ЯТСаЮЪЬтЃК
(1)дкCo+ЕФДпЛЏзїгУЯТЃЌCO(g)ЛЙдN2O(g)ЕФЗДгІРњГЬКЭФмСПБфЛЏШчЭМЫљЪО(внГіКѓЮяжЪШЯЮЊзДЬЌЯТЗЂЩњБфЛЏЃЌдкЭМжаТдШЅ)ЁЃвбжЊзмЗДгІЕФЛЏбЇЗНГЬЪНЮЊЃКCO(g)+N2O(g)![]() CO2(g)+N2(g)ЁЃ
CO2(g)+N2(g)ЁЃ
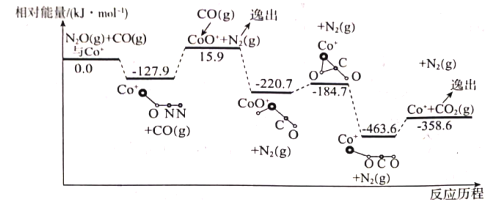
ИУЗДгІЗжСНВННјааЃК
ЕквЛВНЃКCo+(s)+N2O(g)![]() CoO+(s)+N2(g) ЁїH1=+15.9kJmol-1ЃЛ
CoO+(s)+N2(g) ЁїH1=+15.9kJmol-1ЃЛ
ѓЪЖўВНЃК___ЃЛЁїH2=___ЃЛ
ЂйЬюаДЕкЖўВНЗДгІЕФШШЛЏбЇЗНГЬЪНЃЌВЂИљОнЗДгІРњГЬЭММЦЫуЁїH2ЕФЪ§жЕЁЃ
ЂкИУЗДгІЕФзюИпФмРн(ЛюЛЏФм)ЮЊ___ЁЃ
(2)500ЁцЬѕМўЯТЃЌдкШнЛ§ОљЮЊ2LЕФШ§ИіУмБеШнЦїжаЃЌАДВЛЭЌЗНЪНЭЖШыЗДгІЮяЃЌЗЂЩњЩЯЪіЗДгІЃЌВтЕУЯрЙиЪ§ОнШчЯТБэЃК
ШнЦї | ЗДгІЮяЭЖШыЕФСП | ЦНКтЪБ n(N2/mol) | ДяЕНЦНКтЫљашЪБМф/min | ЦНКтЪБФмСПБфЛЏ/kJ |
Мз | 1molCOКЭ1molN2O | n1 | t1 | ЗХШШQ1 |
вв | 2molCOКЭ2molN2O | n2 | t2 | ЗХШШQ2 |
Бћ | 2molCO2КЭ2molN2 | n3 | t3 | ЮќШШQ3 |
ЂйQ1+![]() ___358.6(ЬюЁА>ЁБЁА=ЁБЛђЁА<ЁБЯТЭЌЃЌt1___t2ЃЛ
___358.6(ЬюЁА>ЁБЁА=ЁБЛђЁА<ЁБЯТЭЌЃЌt1___t2ЃЛ
Ђк500ЁцЬѕМўЯТЃЌввКЭБћСНШнЦїЃЌЦјЬхЛьКЯЮяжаN2OЕФЮяжЪЕФСПЗжЪ§x(N2O)гыЗДгІЪБМфtЕФЙиЯЕШчЯТБэЃК
t/s | 0 | 20 | 40 | 60 | 80 | 120 | |
вв | x(N2O) | 0.5 | 0.32 | 0.20 | 0.12 | 0.088 | 0.07 |
Бћ | x(N2O) | 0 | 0.030 | 0.048 | 0.059 | 0.065 | 0.07 |
ИљОнЩЯЪіЪЕбщНсЙћЃЌМЦЫуГіввШнЦїжа0~20sЪБМфФкЕФЛЏбЇЗДгІЫйТЪv(CO)=___ЃЛИУЗДгІЕФЦНКтГЃЪ§KЪ§жЕЮЊЃК___ЃЛ(БЃСє3ЮЛгааЇЪ§зж)
ЂлЧыЭЦВтВЂдкЭМжаЛГіМзШнЦїжаx(N2O)ЫцЪБМфБфЛЏЕФЙиЯЕЭМЯѓЃЌБъГіЧЁКУДяЕНЦНКтЪБПЬЕуЕФЮЛжУ___ЁЃ

(3)ШєНЋCO(g)ЛЙдN2O(g)ЕФЗДгІЩшМЦГЩШчЭМЕФдЕчГизАжУЃЌдђИУЕчГие§МЋЕФЕчМЋЗДгІЪНЮЊ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNAЮЊАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.БъзМзДПіЯТЃЌ2.24LCH3OHЗжзгжаЙВМлМќЕФЪ§ФПЮЊ0.5NA
B.100g46%ЕФМзЫс(HCOOH)ЫЎШмвКжаЫљКЌЕФбѕдзгЪ§ФПЮЊ5NA
C.lmolЬњЗлИпЮТЯТгызуСПЫЎеєЦјЗДгІЃЌзЊвЦЕчзгЪ§ЮЊ3NA
D.2molSO2КЭlmolO2дкДпЛЏМСзїгУЯТГфЗжЗДгІЫљЕУЗжзгзмЪ§ЮЊ2NA
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУБъзМбЮЫсШмвКВтЖЈФГNaOHШмвКЕФХЈЖШЃЌгУМзЛљГШзїжИЪОМСЃЌЯТСаВйзїжаПЩФмЪЙВтЖЈНсЙћЦЋЕЭЕФЪЧЃЈ ЃЉ
A.ЫсЪНЕЮЖЈЙмдкзАЫсвКЧАЮДгУБъзМбЮЫсШмвКШѓЯД2ЁЋ3ДЮ
B.ПЊЪМЪЕбщЪБЫсЪНЕЮЖЈЙмМтзьВПЗжгаЦјХнЃЌдкЕЮЖЈЙ§ГЬжаЦјХнЯћЪЇ
C.зЖаЮЦПФкШмвКбеЩЋБфЛЏгЩЛЦЩЋБфГШЩЋЃЌСЂМДМЧЯТЕЮЖЈЙмвКУцЫљдкПЬЖШ
D.ЪЂNaOHШмвКЕФзЖаЮЦПЕЮЖЈЧАгУNaOHШмвКШѓЯД2ЁЋ3ДЮ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаТаЭЮЂЩњЮяЕчГиПЩРћгУЩњЛюРЌЛјЗЂЕчЃЌЦфЙЄзїдРэШчЭМЫљЪОЃЌЯТСагаЙиЫЕЗЈжаДэЮѓЕФЪЧЃЈ ЃЉ
A.XЕчМЋЕФЗДгІЪНЮЊЃК(C6H10O5)n+7nH2O-24neЃ=6nCO2Ёќ+24nH+
B.УПЯћКФ1molO2ЪБЛсга4molжЪзгЭЈЙ§жЪзгНЛЛЛФЄ
C.ЙЄзїЪБЭтЕчТЗЕчСїгЩИКМЋСїЯђе§МЋ
D.ЮЂЩњЮяЫљЦ№зїгУгыДпЛЏМСЯрЕБ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВПЗжШѕЫсЕФЕчРыЦНКтГЃЪ§ШчБэЃК
ШѕЫс | HCOOH | HClO | H2CO3 | H2SO3 |
ЕчРыЦНКт ГЃЪ§ЃЈ25ЁцЃЉ | KaЃН1.77ЁС10Ѓ4 | KaЃН4.0ЁС10Ѓ8 | Ka1ЃН4.3ЁС10Ѓ7 Ka2ЃН4.7ЁС10Ѓ11 | Ka1ЃН1.54ЁС10Ѓ2 Ka2ЃН1.02ЁС10Ѓ7 |
ЃЈ1ЃЉЪвЮТЯТЂй0.1molЁЄL-1HCOONaЃЛЂк0.1molЁЄL-1NaClOЃЛЂл0.1molЁЄL-1Na2CO3ЃЛЂм0.1molЁЄL-1NaHCO3ЫФжжШмвКЕФpHгЩДѓЕНаЁЕФЙиЯЕЮЊ________________ЁЃЃЈгУађКХЬюПеЃЉ
ЃЈ2ЃЉХЈЖШОљЮЊ0.1 molЁЄLЃ1ЕФNa2SO3КЭNa2CO3ЕФЛьКЯШмвКжаЃЌSO32-ЁЂCO32-ЁЂHSO3-ЁЂHCO3-ХЈЖШДгДѓЕНаЁЕФЫГађЮЊ________________ЁЃ
ЃЈ3ЃЉЯТСаРызгЗНГЬЪНе§ШЗЕФЪЧ___________ЃЈЬюзжФИЃЉЁЃ
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2Ёќ
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
ЃЈ4ЃЉФГЮТЖШЃЈTЁцЃЉЯТЕФШмвКжаЃЌcЃЈH+ЃЉ=10-xmolЁЄL-1ЃЌcЃЈOH-=10-ymolЁЄL-1ЃЌxгыyЕФЙиЯЕШчЭМЫљЪОЁЃ
ЂйДЫЮТЖШЯТЃЌ0.01mol/LЕФNaOHШмвКжаЫЎЕчРыГіЕФOH-ХЈЖШЮЊ_______ЁЃ
ЂкдкДЫЮТЖШЯТЃЌ0.1molЁЄL-1ЕФNaHSO4ШмвКгы0.1molЁЄL-1ЕФBa(OH)2ШмвКАДЯТБэжаМзЁЂввЁЂБћЁЂЖЁВЛЭЌЗНЪНЛьКЯЃК
Мз | вв | Бћ | ЖЁ | |
0.1molЁЄL-1ЕФBaЃЈOHЃЉ2 | 10 | 10 | 10 | 10 |
0.1molЁЄL-1ЕФNaHSO4 | 5 | 10 | 15 | 20 |
АДМзЗНЪНЛьКЯКѓЃЌЫљЕУШмвКЕФpHЮЊ____________ЃЛ
АДввЗНЪНЛьКЯКѓЃЌЦфЗДгІЕФРызгЗНГЬЪНЃК_________________ЁЃ
АДЖЁЗНЪНЛьКЯКѓЃЌЫљЕУШмвКЯд____________ЃЈЬюЁАЫсЁБЁАМюЁБЛђЁАжаЁБЃЉад
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІжаЃЌЫЎжЛзїбѕЛЏМСЕФЪЧ
ЂйЗњЦјЭЈШыЫЎжа ЁЁ ЂкЫЎеєЦјОЙ§зЦШШЕФНЙЬП ЁЁ ЂлФЦПщЭЖШыЫЎжа ЁЁ
ЂмЬњгыЫЎеєЦјЗДгІ ЁЁ ЂнТШЦјЭЈШыЫЎжа
A. жЛгаЂйЂм B. жЛгаЂйЂн
C. жЛгаЂкЂл D. жЛгаЂкЂлЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЕФФГШнЛ§ПЩБфЕФУмБеШнЦїжаЃЌНЈСЂЯТСаЛЏбЇЦНКтЃКC(s)ЃЋH2O(g)![]() CO(g)ЃЋH2(g)ЁЃВЛФмШЗЖЈЩЯЪіПЩФцЗДгІдквЛЖЈЬѕМўЯТвбДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ
CO(g)ЃЋH2(g)ЁЃВЛФмШЗЖЈЩЯЪіПЩФцЗДгІдквЛЖЈЬѕМўЯТвбДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ
A. ЬхЯЕЕФЬхЛ§ВЛдйЗЂЩњБфЛЏ B. ЩњГЩn mol COЕФЭЌЪБЯћКФn mol H2O
C. vе§(CO)ЃНvФц(H2O) D. 1 mol HЁЊHМќЖЯСбЕФЭЌЪБЖЯСб2 mol HЁЊOМќ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com