
【题目】有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子的L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。
回答下列问题:
(1)V的一种核素中质子数为中子数的![]() ,则该核素的名称为________,常用于制造________。
,则该核素的名称为________,常用于制造________。
(2)W元素在周期表中的位置为_______________________________。
(3)X元素的离子结构示意图为________。
(4)Z的最高价氧化物对应水化物的化学式为:_________________________。
【答案】氚 氢弹 第二周期 第VIA族 ![]() KOH
KOH
【解析】
V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,W原子L层电子数是K层电子数的3倍,其L层电子数为6,则W为O元素;W和Y元素原子的最外层电子数相同,二者处于同主族,则Y为S元素;只有X、Z是金属元素,V和Z元素原子的最外层电子都只有一个,处于ⅠA族,由原子序数可知,Z为K元素、V为H元素;X元素原子的最外层电子数是Y(S)元素原子最外层电子数的一半,则X原子最外层电子数为3,且X原子序数大于O元素,则X为Al元素,据此解答。
V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,W原子L层电子数是K层电子数的3倍,其L层电子数为6,则W为O元素;W和Y元素原子的最外层电子数相同,二者处于同主族,则Y为S元素;只有X、Z是金属元素,V和Z元素原子的最外层电子都只有一个,处于ⅠA族,由原子序数可知,Z为K元素、V为H元素;X元素原子的最外层电子数是Y(S)元素原子最外层电子数的一半,则X原子最外层电子数为3,且X原子序数大于O元素,则X为Al元素;
(1)V是氢,氢的一种核素中质子数为中子数的![]() ,所以中子数为2,则该核素的符号为31H,名称为氚,常用于制造氢弹;
,所以中子数为2,则该核素的符号为31H,名称为氚,常用于制造氢弹;
(2)W为O元素,其原子序数为8,最外层含有6个电子,氧原子结构示意图为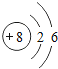 ,则氧元素在周期表中的位置是第二周期 第VIA族;
,则氧元素在周期表中的位置是第二周期 第VIA族;
(3)X是Al元素,铝离子的核电荷数为13,核外电子总数为10,其离子结构示意图为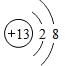 ;
;
(4)Z为K元素,其最高价氧化物对应水化物的化学式为KOH。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.淀粉和纤维素互为同系物
B.水可以用来分离苯和苯酚的混合物
C.植物油氢化过程中发生了还原反应
D.环己烯与甲苯可用酸性KMnO4溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是
A. CuI既是氧化产物又是还原产物
B. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol![]() 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:
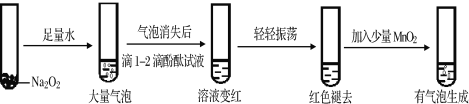
①用化学方程式解释使酚酞试液变红的原因_______________________,
依据实验现象推测红色褪去的原因是_________________。
②加入MnO2反应的化学方程式为________________________。
③ Na2O2的电子式为_____________
(2)实验小组两名同学共同设计如下装置探究过氧化钠与二氧化硫的反应。通入SO2,将带余烬的木条插入试管C中,木条复燃。
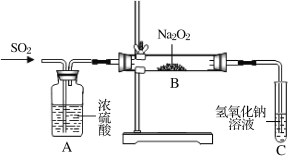
请回答下列问题:
①甲同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是____。
检验反应后B中的白色固体含有Na2SO3的方法是_________________。
②乙同学认为反应的后B中有Na2SO3还会有Na2SO4。乙同学猜想的理由是:_____。
为检验产物中Na2SO4的存在,乙同学设计并实施了如下实验方案:
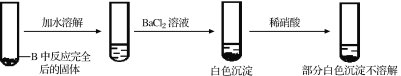
甲同学认为该实验方案的现象不能证明有Na2SO4生成,其理由为_______。
③ 测定B中反应完全后的固体中Na2SO4含量的实验方案:称取样品a 克加水溶解,_______,烘干,称量得BaSO4沉淀b 克,则Na2SO4的质量分数为____(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池在现代生活中有广泛应用,它的充、放电反应按下式进行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
Cd(OH)2+2Ni(OH)2 ,由此判断错误的是:( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-=Cd(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为 3.8 ℃,42 ℃以上会分解生成 Cl2和O2, Cl2O易溶于水并与水立即反应生成 HClO。
资料2:将氯气和空气(不参与反应)按体积比 1∶3 混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O![]() Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
Cl2O+2NaCl+2NaHCO3,用水吸收 Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液

回答下列问题:
(1)各装置的连接顺序为_____→_____→_____→____→E。
(2)装置 A 中反应的离子方程式是______。
(3)装置 E中反应的化学方程式是_____。
(4)装置 B 中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置 C 的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
(7)若装置B中生成的Cl2O气体有20%滞留在E前各装置中,其余均溶于装置E的水中,装置E所得500mL次氯酸溶液浓度为0.8mol/L,则至少需要含水8%的碳酸钠的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和气态烯烃组成的混合物共10 g,混合气体的密度是相同状况下氢气密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4 g,该混合气体的组分可能是( )
A. 乙烯和乙烷B. 乙烷和丙烯C. 甲烷和乙烯D. 丙烯和丙烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com