
【题目】在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:![]() ,达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
,达到平衡时,生成了2molC,经测定D的浓度为0.5mol/L,下列判断正确的是 ( )
A.x=1
B.B的转化率为20%
C.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
D.平衡时A的浓度为0.75mol/L
科目:高中化学 来源: 题型:
【题目】以CuSO4溶液和不同酸根离子形成的钠盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
| 滴管 | 试管 | |
0.2molL-1 CuSO4溶液 | 0.2molL-1NaI溶液 | Ⅰ.产生白色沉淀和黄色溶液 | |
0.2molL-1Na2CO3溶液 | Ⅱ.产生绿色沉淀和无色无味气体 | ||
0.2molL-1Na2SO3溶液 | Ⅲ.产生棕黄色沉淀 | ||
(1)经检验,现象Ⅰ的白色沉淀为CuI,则反应的离子方程式为___,氧化产物与还原产物的物质的量之比为___。
(2)经检验,现象Ⅱ中产生的气体是二氧化碳,绿色沉淀是碱式碳酸铜[xCuCO3yCu(OH)2zH2O]。现采用氢气还原法测定碱式碳酸铜组成,请回答如下问题:
①写出xCuCO3yCu(OH)2zH2O与氢气反应的化学方程式___;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填仪器接口字母编号):a→___→gf→___→___→___→l

(3)经检验,现象Ⅲ的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。已知:Cu+![]() Cu+Cu2+
Cu+Cu2+
①用稀硫酸证实沉淀中含有Cu+的实验现象是___。
②通过下列实验证实,沉淀中含有Cu2+和SO32-。

a.白色沉淀A是BaSO4,试剂Ⅰ是___。
b.证实沉淀中含有Cu2+和SO32-的理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g Na和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是
A.整个反应过程中共转移电子0.4 mol
B.反应产生的气体在标准状况下的体积是1.12L
C.反应所得溶液与足量CO2反应的离子方程式:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D.在稀释、定容操作中用到的全部玻璃仪有:烧杯、玻璃棒、500mL容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是 ( )
A.尼泊金酸与碳酸氢钠反应:![]() +2HCO
+2HCO![]()
![]()
![]() +2CO2
+2CO2![]() +2H2O
+2H2O
B.醋酸溶液与新制氢氧化铜反应:2 H++Cu(OH)2→Cu2++2H2O
C.苯酚钠溶液中通入少量二氧化碳: C6H5O-+CO2 +H2O → C6H5OH+HCO![]()
D.甲醛溶液与足量的银氨溶液共热HCHO+2[Ag(NH3)2]++2OH-![]() CO
CO![]() +2NH
+2NH![]() + 2Ag↓+ 2NH3+ H2O
+ 2Ag↓+ 2NH3+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1。向 2L 密闭容器中通入1mol N2 和 4mol H2,5 分钟达到平衡,此时容器压强为起始时的 0.8,则下列说法正确的是
2NH3(g)ΔH=-92 kJ·mol-1。向 2L 密闭容器中通入1mol N2 和 4mol H2,5 分钟达到平衡,此时容器压强为起始时的 0.8,则下列说法正确的是
A.5min 内,NH3 的平均速率为 0.15 mol/(L·min)
B.H2的转化率为 50%
C.反应放出 92kJ 热量
D.该反应的化学平衡常数表达式为 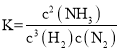
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A. 0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合产生沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3H2O
B. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C. NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ ![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国成功发射的“嫦娥”卫星和“玉兔”月球车对探究月球结构和资源开发具有极为重要的战略意义。请回答下列问题:
(1)发射“嫦娥”卫星使用了大功率运载火箭,火箭推进器中装有还原剂肼![]() 和强氧化剂过氧化氢
和强氧化剂过氧化氢![]() ,其反应为
,其反应为 ,已知生成
,已知生成![]() 释放出
释放出![]() 热量。
热量。
①写出![]() 在催化剂作用下分解的化学方程式:_______。
在催化剂作用下分解的化学方程式:_______。
②用电子式表示![]() 的形成过程:_______。
的形成过程:_______。
③若该火箭推进器中![]() 有
有![]() 共价键发生断裂,释放出的热量为_______
共价键发生断裂,释放出的热量为_______![]() 。
。
(2)镍氢蓄电池具有能量密度大、电压高、可多次反复充放电等特性而被用于“玉兔”月球车上,![]() 溶液作电解液,其放电时,正极的电极反应式为
溶液作电解液,其放电时,正极的电极反应式为![]() ,负极的电极反应式为
,负极的电极反应式为 ,利用太阳能充电时负极的电极反应式为
,利用太阳能充电时负极的电极反应式为 。
。
①该镍氢蓄电池放电时的总反应方程式为_______。
②该电池利用太阳能充电时正极的电极反应式为_______。
③该电池工作时,![]() 向_______(填“正极”或“负极”)迁移。
向_______(填“正极”或“负极”)迁移。
④假设电池工作时有![]() 个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
个电子从负极流向正极,则消耗的H2在标准状况下的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,C(s)+![]() O2(g)=CO(g) △H1=-110.5kJ/mol
O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是( )
A.①是碳的燃烧热的热化学方程式
B.碳的燃烧热大于110.5kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略) ( )
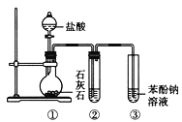
A.②中试剂为饱和Na2CO3溶液
B.打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
C.苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D.③中反应:2![]() +CO2+H2O→2
+CO2+H2O→2![]() +Na2CO3
+Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com