
����Ŀ�����������ù�ҵұ������ͭ(����Fe2+��AsO2-��Ca2+������)�ᴿ�Ʊ��������ͭ���������̡�

��֪����Fe3+ Cu2+ ��ʼ������pH�ֱ�2��7��5��4����ȫ������pH�ֱ�Ϊ3��7��6��4;
��KSP[(Cu(OH)2]=2��10-20
��1���ܽ��������Ҫ���ƺ�ͭ64g/L������ͭ��Һ100L����Ҫ����ұ��������ͭ����������Ϊ Kg��
��2�����������з��������ӷ�Ӧ����ʽΪ��
��AsO2�� + H2O2+ H+=H3AsO4 �� H3AsO4+ Fe3+=FeAsO4��+ 3H+
��3����Ҫ�������pH����Һ��Fe3+�Ƿ������������ ����������Ҫ����Һ����ϡ�ͣ�ϡ�ͺ����Һ��ͭ����Ũ������ܳ��� mol��L-1��
��4������I����Ҫ�ɷֳ� FeAsO4��� ��������Ϊ
��5���������ϵ�Ƽ�����ͭ��Ϊ�������Һ������ͭ�������������ʣ��Ʊ���ͭ��д�����������ĵ缫��Ӧ����ʽ
���𰸡���16����
��1��16 ��2����
��2��H2O2+2 H+ +2Fe2+ = 2Fe3+ +2H2O ��2����
��3��ȡ������Һ�����Թ�, ���뼸��KSCN��Һ������Һ�����ֺ�ɫ����˵��Fe3+�Ѿ�������2��10-2
����2�֣���4�֣�
��4��Fe(OH)3��CaCO3����1�֣���2�֣�������Ũ������ȴ�ᾧ�����˸��2�֣�������������ɣ�
��5��Fe��2e��= Fe2+ ��Cu ��2e��= Cu2+ ����2������4����
��������
�����������1��m��CuSO4��=64g/L��100L����64/160��=16000g=16Kg��
��2����Һ�к����л�ԭ�Ե�Fe2+��H2O2��Fe2+����������ԭ��Ӧ�����ӷ���ʽΪ��H2O2+2 H+ +2Fe2+ = 2Fe3+ +2H2O��
��3��Fe3+����SCN��Ӧ����Һ��Ϊ��ɫ�������������pH����Һ��Fe3+�Ƿ��������������ȡ������Һ�����Թ�, ���뼸��KSCN��Һ������Һ�����ֺ�ɫ����˵��Fe3+�Ѿ���������Ϊ��Ҫ����Һ��pH������5����c��OH��=10-9molL1������KSP[(Cu(OH)2]�ɵ�Cu2+ǡ�ó���ʱ��Cu2+Ũ��Ϊ��c��Cu2+��=2��10-20����10-9��2=2��10-2��ϡ�ͺ����Һ��ͭ����Ũ������ܳ���2��10-2molL1��
��4������Na2CO3��CO32��Ca2+��Ӧ����CaCO3������Fe3+��ʼ������pH�ֱ�2��7����ȫ������pH�ֱ�Ϊ3��7������pH������5ʱ��Fe3+ת��ΪFe(OH)3��������������I����Ҫ�ɷֳ� FeAsO4���Fe(OH)3��CaCO3����������ͼ��֪�����������õ��������ͭ����ҺII����������Ϊ������Ũ������ȴ�ᾧ�����˸�����
��5������ͭ�������������ʣ��Ʊ���ͭ������Ϊ��ͭ����ͭ��Fe��Cu������ʧȥ���ӣ��������������ĵ缫��Ӧ����ʽΪ��Fe��2e��= Fe2+ ��Cu ��2e��= Cu2+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и����������ʣ� A��O2��O3
B�� ![]() ��
�� ![]()
C��CH3CH2CH2CH3�� ![]()
D�� 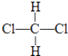 ��
�� 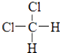
E��CH3CH2CH2CH3�� ![]()
��i������������Ϊͬλ�أ�
��ii�����������ʻ�Ϊͬ�������壻
��iii��������������������
��iv���������ʻ�Ϊͬ���칹�壻
��v������������ͬһ���ʣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ���ǣ� ��
A.ˮ�����ӻ�KWֻ���¶��йأ���ˮ�ĵ���̶�һ����������ᡢ��ε�Ӱ��
B.��HA��Ka=1.7��10��5 �� BOH��Kb=1.7��10��5 �� ��HA��Һ�е�c��H+����BOH�е�c��OH�������
C.��0.2mol/L HA��Һ��0.1mol/L NaOH��Һ�������ϣ���Ӧ��Ļ��Һ�У�c��OH����+c��A����=c��H+��+c��HA��
D.Mg��OH��2������NH4ClŨ��Һ����Ҫԭ����NH4+���OH��ʹ�����ܽ�ƽ�ⷢ�������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����nAΪ�����ӵ���������ֵ������˵����ȷ����
A�������£�78g�ı�����3nA��![]() ˫��
˫��
B��1L 0��1 mol��L-1��NH4Cl��Һ����0��1nA��NH4+
C����״���£�22��4 L SO2��CO2����ﺬ��2nA��Oԭ��
D�������£�5��6 g����Ͷ������Ũ������ʧȥ0��3nA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����������������Ⱦ���������·�Ӧ��CH4��g��+2NO2��g��N2��g��+CO2��g��+2H2O��g����H=a kJ/mol ���¶�T1��T2ʱ���ֱ�0.50mol CH4��1.2mol NO2�������Ϊ1L���ܱ������У����n��CH4����ʱ��仯�������±�������˵������ȷ���ǣ� ��
�¶� | ʱ��/min | 0 | 10 | 20 | 40 | 50 |
T1 | n��CH4�� | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n��CH4�� | 0.50 | 0.30 | 0.18 | �� | 0.15 |
A.10 min�ڣ�T1ʱCH4�Ļ�ѧ��Ӧ���ʱ�T2ʱС
B.�¶ȣ�T1��T2
C.a��0
D.ƽ�ⳣ����K��T1����K��T2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ��Ͷ��ˮ����Na��2H2O=Na+��2OH����H2��
B. �ô����ȥˮƿ�е�CaCO3��CO![]() +2H��=CO2����H2O
+2H��=CO2����H2O
C. Al����NaOH��Һ��2Al��2H2O +2OH��=2AlO![]() ��3H2��
��3H2��
D. Fe��ϡ���ᷴӦ��2Fe��6H��=2Fe3+��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����ڹ�ũҵ�������ճ�������Ӧ�÷dz��㷺��
��1���ɻ�ͭ����ȡͭ�ķ�Ӧ����Ϊ��
2Cu2S��s��+3O2 ��g��=2Cu2O��s��+2SO2��g����H=��768.2kJmol��1 ��
2Cu2O��s��+Cu2S��s��=6Cu��s��+SO2��g����H=+116.0kJmol��1 ��
��д��Cu2S��O2��Ӧ����Cu��SO2���ȷ�Ӧ����ʽ�� ��
��2���Ȼ�ͭ��Һ��ͭ�����ֵķֲ�������ƽ��ʱij���ֵ�Ũ��ռ������Ũ��֮�͵ķ�������c��Cl���� �Ĺ�ϵ��ͼ1���ٵ�c��Cl����=9molL��1ʱ����Һ����Ҫ��3�ֺ�ͭ����Ũ�ȴ�С��ϵΪ �� 
����c��Cl����=1molL��1���Ȼ�ͭ��Һ�У�����AgNO3��Һ����ͭ���ּ�ת�������ӷ���ʽΪ����дһ������
��3�����Na2HPO3��Һ�ɵõ������ᣬװ����ͼ2
��˵������Ĥֻ����������ͨ������Ĥֻ����������ͨ����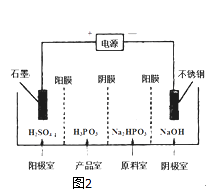
�������ĵ缫��ӦʽΪ�� ��
�ڲ�Ʒ���з�Ӧ�����ӷ���ʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Ti)�Ļ�еǿ�ȸߣ�����ʴ����ǿ���С�δ��������֮�ơ���TiO2�ƽ����ѣ���Ҫ��Ӧ�У�
��TiO2��2C��2Cl2 ![]() TiCl4��2CO�� ��TiCl4��2Mg
TiCl4��2CO�� ��TiCl4��2Mg![]() 2MgCl2��Ti
2MgCl2��Ti
������������ȷ����
A. ��Ӧ����TiO2�������� B. ��Ӧ�ڱ����˽���þ��ԭ�ԱȽ�����ǿ
C. ��Ӧ����̼�ǻ�ԭ�� D. ��Ӧ�����������뻹ԭ�����ʵ���֮��Ϊ1��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£�����һ��������������������Ϊ74.6g�����ij䵪����������Ϊ66g�����������ݻ�Ϊ
A.11.2LB.5.6LC.4.48LD.2.24L
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com