
【题目】单质钛(Ti)的机械强度高,抗腐蚀能力强,有“未来金属”之称。以TiO2制金属钛,主要反应有:
①TiO2+2C+2Cl2 ![]() TiCl4+2CO; ②TiCl4+2Mg
TiCl4+2CO; ②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
下列叙述不正确的是
A. 反应①中TiO2是氧化剂 B. 反应②表现了金属镁还原性比金属钛强
C. 反应①中碳是还原剂 D. 反应①中氧化剂与还原剂物质的量之比为1∶1
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
【题目】0.2L1mol·L-1的KCl溶液和0.5L1mol·L-1的FeCl3溶液中,Cl-的浓度之比是
A.1:3B.3:1C.1:1D.2:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要含Fe2O3和SiO2)制备绿矾(FeSO4·7H2O),再通过绿矾制备铁矾[FeO(OH)]的流程如下:(已知FeS2和铁矾均难溶于水)
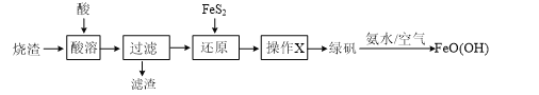
(1)“酸溶”步骤中,最好采用___________________(填“盐酸”、“硫酸”或“硝酸”)溶解烧渣。
(2)写出“还原”步骤发生反应的离子方程式:___________________。
(3)对“还原”后的溶液进行“操作X”,可得到绿矾。“操作X”是指___________________,过滤,洗涤,干燥。
(4)请补充完整检验“还原”后所得溶液中是否含有Fe3+的实验方案:取“还原”后溶液于试管内,___________________。
(5)最后一步制备铁矾的反应中,还生成一种可作化肥的物质,它的化学式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的说法错误的是( )
A. 氧化剂得电子,还原剂失电子
B. 某元素从化合态到游离态,可能被氧化也可能被还原
C. 难失去电子的原子,不一定易得电子
D. 一种元素被氧化,一定有另一种元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3PO2(次磷酸)是一种一元弱酸,H3PO2易溶于水且具有较强的还原性。
(1)H3PO2的结构式为____________________。
(2)H3PO2在水溶液中的电离方程式为_____________________。
(3)不断将新制的PH3通入搅拌的碘悬浮液中,直至碘的颜色消失,可得到次磷酸和氢碘酸,则该反应中氧化产物与还原产物的物质的量之比为__________________。
(4)酸性条件下,H3PO2可将Cr2O72-还原为Cr3-,其本身被氧化为磷酸,该反应的离子方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
B.标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA
C.常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算
D.0.1 molL﹣1MgCl2溶液中含有的Mg2+数目小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com