
����Ŀ����������0.1molL��1������ҺNaOH��NH3H2O��HCl��CH3COOH
��1����֪CH3COOH��Һ��pH=3��������Ϊ �� ��ˮ�����c��H+��=molL��1 ��
��2����ͬpH��CH3COOH��Һ��HCl��Һ��ˮϡ�ͣ���pH�仯�����ͼ�����б�ʾHCl��Һ�������� �� a��b�����У�����������ǿ���� �� 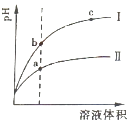
��3��NH3H2O��Һ��HCl��Һ��ϣ���֪���V��NH3H2O����V��HCl��������Һ��c��NH3H2O��=c��NH4+��ʱ����Һ��pH= �� [��֪��Kb��NH3H2O��=1.77��10��5 �� lg 1.77=0.25]��
���𰸡�
��1��1%��10��11
��2��I��a
��3��9.25
���������⣺��1����CH3COOHCH3COO��+H+֪��c��H+�������Ѿ������c��CH3COOH���������Ѿ�����Ĵ���Ũ����1.0��10��3mol/L�� ���Ԧ�= ![]() ��100%=
��100%= ![]() ��100%=1%��pH=3�Ĵ�����Һ�У�c��OH����=
��100%=1%��pH=3�Ĵ�����Һ�У�c��OH����= ![]() =10��11mol/L��������Һ������������ȫ����ˮ���룬����ˮ����������ӵ���ˮ��������������ӣ�����ˮ�����c��H+��=10��11molL��1 �� ��
=10��11mol/L��������Һ������������ȫ����ˮ���룬����ˮ����������ӵ���ˮ��������������ӣ�����ˮ�����c��H+��=10��11molL��1 �� ��
���Դ��ǣ�1%��10��11����2��pH��ȵĴ���������У���ˮϡ�ʹٽ�������룬ϡ����ͬ�ı���������������Ũ�ȴ������ᣬ����pH�仯���Ϊǿ�ᣬ����ͼ��֪��IΪ���
��Һ�ĵ�������������Ũ�ȳ����ȣ�������Ũ��Խ����Һ��pHԽС��������Һ���������ϴ����a��
���Դ��ǣ���a����3����֪Kb��NH3H2O��= ![]() =1.77��10��5 �� ����Ϊc��NH3H2O��=c��NH4+������c��OH����=1.77��10��5 �� ����c��H+��=
=1.77��10��5 �� ����Ϊc��NH3H2O��=c��NH4+������c��OH����=1.77��10��5 �� ����c��H+��= ![]() ����pH=9.25��
����pH=9.25��
���Դ��ǣ�9.25��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��ͬѧ����NaHCO3��KHCO3��ɵ�ij���Ȼ�������ʵ�飬����������ݣ���������ʵ���Ũ����ȣ�
50mL���� | 50mL���� | 50mL���� | |
m������ | 9.2g | 15.7g | 27.6g |
V��CO2��������� | 2.24L | 3.36L | 3.36L |
�Լ��㣺
��1������������ᷴӦ�����ӷ���ʽ
��2����������ʵ���Ũ�ȣ�
��3��������������ʵ����ʵ���֮�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㣮��ҵ�Ͽɽ��������������У�������FeCl2 �� ��ͨ��Cl2�������Ʊ�FeCl3��Һ��
��֪���ٱ�״���£�1���ˮ��������ܽ�500�����HCl���ڱ���NaCl��Һ��Ũ��ԼΪ5.00molL��1 ��
��1���ڱ�״���£���44.8LHCl��������100mLˮ�У�������ҺA���ܶ�Ϊ1.038gcm��3 �� ����Һ��HCl�����ʵ���Ũ��Ϊ������ʹ����NaCl��Һ��Cl��Ũ������ҺA�е�Cl��Ũ����ȣ���Ӧ�ܽ�ԼL��״��HCl���壨��Һ����仯���Բ��ƣ���
��2����ʵ������0.5molL��1NaCl��Һ240mL����Ӧ��ȡ�����mL�ı���NaCl��Һ�����ƣ������ƹ���
�У�ʹ��ǰ�������Ƿ�©Һ�����������������Ʋ���������ҺŨ��ƫ�ߵ�����ѡ���ţ���
A����ȡ��Һʱ������Һ�彦��
B������ƿ������ˮϴ�Ӹɾ���δ����
C������ʱ������Һ���ˮ���̶���
D��ת��Һ���δ������ˮϴ���ձ��Ͳ�����
E������Ͳ��ȡ��Һʱ���Ӷ���
F������ʱ�����������ߣ������ý�ͷ�ι��������ಿ��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ�������ӷ���ʽ��ʾ������100mL��1molL��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����0.1NA������ڡ��������ڡ���С�ڡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��Cl2�������������������ˮ�������߱��ʵȷ���Ӧ�ù㷺��ij��ȤС��ͨ����ͼ1װ�ã��г�װ���ԣ������Ʊ������ա��ͷź�Ӧ�ý������о���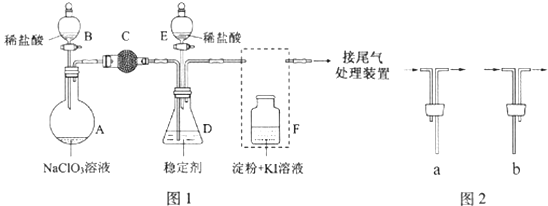
��1������D�������� �� ��װF�е���ʱ��Ӧѡ��ͼ2�е� ��
��2����B�Ļ�����A�з�����Ӧ��2NaClO3+4HCl�T2ClO2��+Cl2��+2NaCl+2H2O��
ΪʹClO2��D�б��ȶ���������գ��μ�ϡ������ٶ�������족����������
��3���ر�B�Ļ�����ClO2��D�б��ȶ�����ȫ��������NaClO2 �� ��ʱF����Һ����ɫ���䣬��װ��C�������� ��
��4����֪������������NaClO2�ɷ�����Ӧ����NaCl���ͷų�ClO2 �� �÷�Ӧ�����ӷ���ʽΪ �� ��ClO2�ͷ�ʵ���У���E�Ļ�����D�з�����Ӧ����װ��F�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ͷ��ụΪͬ���칹�壬���з����в��ܶԶ��߽��м�����ǣ� ��
A.���ý�����
B.��������
C.���ú������
D.���ú˴Ź�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ����������֪������ݣ�
��ѧʽ | ����ƽ�ⳣ����25�棩 |
HCN | K=4.9��10��10 |
CH3COOH | K=1.8��10��5 |
H2CO3 | K1=4.3��10��7��K2=5.6��10��11 |
��1��25��ʱ���е�Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊ ��
��2��25��ʱ��pH=3��CH3COOH��Һ��pH=11��NaOH��Һ��ϣ���������Һ�����ԣ���c��Na+��c��CH3COO���������������������=������
��3��NaCN��Һ��ͨ������CO2 �� ��������Ӧ�Ļ�ѧ����ʽΪ
��4��25��ʱ��pH=8��CH3COONa��Һ�У�c��Na+����c��CH3COO����= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������300������ӣ��������ں������Ļ������ǣ�����
A. ֬��B. ����C. ˮD. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.12g���ۼ���25mL 2mol/L��FeCl3��Һ�У���ַ�Ӧ�������ǣ� ��
A.������ʣ�࣬��Һ��dz��ɫ��Cl���������ֲ���
B.����Һ�е�����ɫKSCN��Һ�����Ժ�ɫ
C.Fe2+��Fe3+���ʵ���֮��Ϊ6��1
D.��������ͻ�ԭ��������ʵ���֮��Ϊ2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3=K2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75mol���������ж���ȷ���ǣ� ��
A.ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol
B.����42.0 L N2����״����
C.��0.250 mol KNO3������
D.����ԭ��Nԭ�ӵ����ʵ���Ϊ3.75 mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com