
����Ŀ��FeCl3��һ�ֺ���Ҫ�����Σ���Ҫ������ˮ����������Ч���á��۸���˵��ŵ㣮��ҵ�Ͽɽ��������������У�������FeCl2 �� ��ͨ��Cl2�������Ʊ�FeCl3��Һ��
��֪���ٱ�״���£�1���ˮ��������ܽ�500�����HCl���ڱ���NaCl��Һ��Ũ��ԼΪ5.00molL��1 ��
��1���ڱ�״���£���44.8LHCl��������100mLˮ�У�������ҺA���ܶ�Ϊ1.038gcm��3 �� ����Һ��HCl�����ʵ���Ũ��Ϊ������ʹ����NaCl��Һ��Cl��Ũ������ҺA�е�Cl��Ũ����ȣ���Ӧ�ܽ�ԼL��״��HCl���壨��Һ����仯���Բ��ƣ���
��2����ʵ������0.5molL��1NaCl��Һ240mL����Ӧ��ȡ�����mL�ı���NaCl��Һ�����ƣ������ƹ���
�У�ʹ��ǰ�������Ƿ�©Һ�����������������Ʋ���������ҺŨ��ƫ�ߵ�����ѡ���ţ���
A����ȡ��Һʱ������Һ�彦��
B������ƿ������ˮϴ�Ӹɾ���δ����
C������ʱ������Һ���ˮ���̶���
D��ת��Һ���δ������ˮϴ���ձ��Ͳ�����
E������Ͳ��ȡ��Һʱ���Ӷ���
F������ʱ�����������ߣ������ý�ͷ�ι��������ಿ��
��3��FeCl3��Һ����������ˮ���侻ˮ��ԭ��Ϊ�������ӷ���ʽ��ʾ������100mL��1molL��1��FeCl3��Һ��ˮʱ�����ɾ��о�ˮ���õ�����0.1NA������ڡ��������ڡ���С�ڡ�����
���𰸡�
��1��12mol/L��291.2
��2��25������ƿ��CE
��3��FeCl3+3H2O?Fe��OH��3�����壩+3HCl��С��
���������⣺��1������£�44.8L HCl�����ʵ���n= ![]() =
= ![]() =2mol��HCl������=2mol��36.5g/mol=73g��100mLˮ������ԼΪ100g����������Һ������Ϊ173g��������Һ�����Ϊ��V=
=2mol��HCl������=2mol��36.5g/mol=73g��100mLˮ������ԼΪ100g����������Һ������Ϊ173g��������Һ�����Ϊ��V= ![]() =
= ![]() mL��������Һ�����ʵ���Ũ��Ϊc=
mL��������Һ�����ʵ���Ũ��Ϊc= ![]() =
= ![]() =12mol/L������NaCl��Һ��Ũ��ԼΪ5.00molL��1 �� �����ܽ���Ȼ������Ϊ��12��5��mol/L��22.4L/mol=291.2L�����Դ��ǣ�12mol/L��291.2����2��������Һ240mL��Ҫѡ��250mL����ƿ��ϡ��ҺΪ0.5molL��1NaCl��Һ������NaCl��Һ��Ũ��ԼΪ5.00molL��1 �� n=cŨVŨ=cϡVϡ �� VŨ=
=12mol/L������NaCl��Һ��Ũ��ԼΪ5.00molL��1 �� �����ܽ���Ȼ������Ϊ��12��5��mol/L��22.4L/mol=291.2L�����Դ��ǣ�12mol/L��291.2����2��������Һ240mL��Ҫѡ��250mL����ƿ��ϡ��ҺΪ0.5molL��1NaCl��Һ������NaCl��Һ��Ũ��ԼΪ5.00molL��1 �� n=cŨVŨ=cϡVϡ �� VŨ= ![]() =25mL������ƿ������ʢ��Һ�壬���л�����ʹ��ʱ�������Ƿ�©ˮ��
=25mL������ƿ������ʢ��Һ�壬���л�����ʹ��ʱ�������Ƿ�©ˮ��
A����ȡ��Һʱ������Һ�彦�����������Ƶ���Һ�����ʵ����ʵ�����С�����Ƶ���ҺŨ��ƫ�ͣ���A����
B������ƿ������ˮϴ�Ӹɾ���δ��������ʵ����ʵ�������Һ��������������Ӱ�죬��������Һ��Ũ����Ӱ�죬��B����
C������ʱ������Һ���ˮ���̶��ߣ�������Һ�����ƫС����Һ��Ũ��ƫ�ߣ���C��ȷ��
D��ת��Һ���δ������ˮϴ���ձ��Ͳ��������������Ƶ���Һ�����ʵ����ʵ�����С�����Ƶ���ҺŨ��ƫ�ͣ���D����
E������Ͳ��ȡ��Һʱ���Ӷ������������Ƶ���Һ�����ʵ����ʵ���ƫ�����Ƶ���ҺŨ��ƫ�ߣ���E��ȷ��
F������ʱ�����������ߣ������ý�ͷ�ι��������ಿ�֣��������Ƶ���Һ�����ʵ����ʵ�����С�����Ƶ���ҺŨ��ƫ�ͣ���F����
���Դ��ǣ�25������ƿ��CE����3��FeCl3ˮ������Fe��OH��3���壬ˮ�ⷽ��ʽΪFeCl3+3H2OFe��OH��3�����壩+3HCl Na2CO3+H2O=NaHCO3+NaOH������������ˮ�е����������ˮ����Ϊˮ��Ϊ���淴Ӧ�������ɽ���Ϊ�����ӵļ����壬�����ɾ��о�ˮ���õ�����С��0.1NA ��
���Դ��ǣ�FeCl3+3H2OFe��OH��3�����壩+3HCl��С�ڣ�


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)д�������ǵķ���ʽ____________ ��ȩ�Ľṹ��ʽ ___________
(2)д����ϩ����ˮ�ķ�Ӧ����ʽ_______________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������100mL 0.10molL��1��CuSO4��Һ�����²���1��5�������ƵĹ��̼�ʾ��ͼ�� 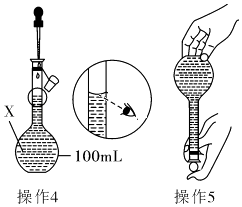
����1��ȷ��ȡһ�������ĵ������岢����������ˮ�ܽ⣮
����2����������Һת�Ƶ�����X�У�������ˮ��ϴ�ձ��Ͳ�����2��3�Σ���ϴ��ҺҲת�Ƶ�X�У�
����3��������X�м�����ˮ��Һ�� ��X�Ŀ̶���l��2cm����
����4������5����ͼ
��1������X����������
��2������1�У�Ӧ��ȡ�������������Ϊ��
��3������������������ȷ�����ݲ���4�������ҺŨ��ѡ�ƫ����ƫС��������Ӱ�족�����жϡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ���ѧ�о���Ա���֣���2%��С�մ�ˮ��������ЧԤ����ǻ�Ĥ��������ķ�������ԭ�п�ǻ�Ĥ�����ˣ�С�մ����ڣ�������
A. �� B. �� C. �� D. ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�Ϻ��ֳ��о�����ʹ�õ�ȼ����Ҫ�ǹܵ�ú�����ֶ���������ʼʹ�ö�����Ȼ����Ϊ����ȼ�ϣ��ܵ�ú������Ҫ�ɷ���CO��H2���������࣬��Ȼ������Ҫ�ɷ���CH4 �� ���ǵ�ȼ�շ�Ӧ���£�2CO��O2![]() 2CO2 2H2��O2
2CO2 2H2��O2![]() 2H2O CH4��2O2
2H2O CH4��2O2![]() CO2��2H2O
CO2��2H2O
�������ϻ�ѧ����ʽ�жϣ�ȼ����ͬ����Ĺܵ�ú������Ȼ�������Ŀ�������ϴ���� �� ���ȼ�չܵ�ú����������������Ȼ������ߵĸĽ������������(�����С��)���粻�Ľ����ܲ����IJ����������
�ܵ�ú���к��е����࣬����������������顢���顢����ȣ����ǵ�ijЩ���ʼ��±���
���� | ���� | ���� | |
�۵�/�� | ��183.3 | ��189.7 | ��138.4 |
�е�/�� | ��88.6 | ��42.1 | ��0.5 |
�Ը�������ij���ؼ����ݽ��Ͷ����Ϻ�������ʱ�ܵ�ú�������С�����ҳʶ���״̬��ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������и��⣺
��1��ͭ��Ũ����ɷ�����Ӧ��Cu+4HNO3��Ũ���TCu��NO3��2 +2NO2��+2H2O������ͭ�������������ԭ������Ũ�����������������ԭ���������ڸ÷�Ӧ�У���������1mol Cu��������mol NO2
��2��3.01��1023���������ӵ����ʵ�������1.5 mol Na2SO410H2O��������Na+�����ʵ����� �� ������SO42�������ʵ����� �� ����H2O����Ŀ��NA
��3��4�����ʣ���NH3����SO2����NaCl��Һ����H2SO4��Һ�����У���ʹƷ����Һ��ɫ����������ţ���ͬ������ɫ��Ӧ�ʻ�ɫ���ǣ����Ȼ����а��̲������� �� ���Ȼ�����Һ��Ӧ������ɫ��������
��4��ijЩ��������Ʒ�ı��泣����һ�����������Ҫ�ɷֱַ���������������������ش� a��������������������ᷴӦ�����ɵ������εĻ�ѧʽ�ֱ�Ϊ�� �� ���������ε���Һ�зֱ�μ���������������Һ���ɹ۲쵽������һ����Һ�е��������Ȳ�����ɫ������Ȼ���ɫ��������ʧ����һ����Һ�е�������������ţ���
�ٲ�����ɫ����
�ڲ������ɫ����
�۲�����ɫ������Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ
b�������������ķ�Ӧ�����ں��Ӹֹ죬�䷴Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ɸ�������ɺ����ʽ��з��ࣺ
��1��Na��K��H��O��C��S��N�������ֻ�����Ԫ����ɺ��ʵ����ʣ�����ѧʽ�ֱ����ڱ��ڵĺ��棻��ֻ����һ�֣�
������� | �� | �� | �� | ������ | �⻯�� |
��ѧʽ | ��H2SO4 | ��NaOH | ��Na2SO4 | ��SO2 | ��NH3 |
��2��д����ת��Ϊ��Ļ�ѧ����ʽ��
��3��д��Cu�͢ٵ�Ũ��Һ��Ӧ�Ļ�ѧ����ʽ��
��4��ʵ�����Ʊ��᳣������Ӧ�����������ķ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������0.1molL��1������ҺNaOH��NH3H2O��HCl��CH3COOH
��1����֪CH3COOH��Һ��pH=3��������Ϊ �� ��ˮ�����c��H+��=molL��1 ��
��2����ͬpH��CH3COOH��Һ��HCl��Һ��ˮϡ�ͣ���pH�仯�����ͼ�����б�ʾHCl��Һ�������� �� a��b�����У�����������ǿ���� �� 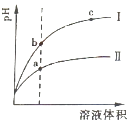
��3��NH3H2O��Һ��HCl��Һ��ϣ���֪���V��NH3H2O����V��HCl��������Һ��c��NH3H2O��=c��NH4+��ʱ����Һ��pH= �� [��֪��Kb��NH3H2O��=1.77��10��5 �� lg 1.77=0.25]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ�ﵽƽ��ĸ���ԭ���ǣ� ��
A.��Ӧ������и���ֵ�Ũ�����
B.���淴Ӧ�����ڼ�������
C.���淴Ӧ�����ʾ�Ϊ��
D.���淴Ӧ���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com