
【题目】N元素是植物生长的必需元素,含氮化合物在工农业生产以及生活中都发挥着重要作用。
(1)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为____。
(2)氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。某化学课外小组查阅资料后得知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快)ΔH1<0 K1
N2O2(g)(快)ΔH1<0 K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0 K2
2NO2(g)(慢)ΔH2<0 K2
反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)
2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
(3)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,v(N2O4)=__________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为____。改变温度至T1时k1=k
【答案】NH4NO3![]() N2O+2H2O ΔH=ΔH1+ΔH2 K= K1K2 ② < 2×10-3mol·L1·min1 k1=60k2 >
N2O+2H2O ΔH=ΔH1+ΔH2 K= K1K2 ② < 2×10-3mol·L1·min1 k1=60k2 >
【解析】
(1)依据质量守恒规律书写化学方程式,注意反应条件;
(2)依据盖斯定律分析结合反应热与平衡常数公式作答;决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率为慢反应;
2NO2(g)的反应速率为慢反应;
(3)设0~20 min内生成N2O4的物质的量是x mol,列出三段式作答;达到平衡时列三段式计算各物质浓度,再根据v正(NO2)∶v逆(N2O4) = 2∶1,结合给定信息求出结论;若使k1=k2,则c(NO2)较原平衡增大,结合温度对平衡的影响因素分析;
(1)依据质量守恒定律可知,该反应的产物应为N2O和H2O,反应的化学方程式为:NH4NO3![]() N2O+2H2O;
N2O+2H2O;
(2)根据盖斯定律分析, ①+②即可得到反应,2NO(g)+O2(g)![]() 2NO2(g),故对应的反应热之间的关系为ΔH=ΔH1+ΔH2;因为反应2NO(g)+O2(g)
2NO2(g),故对应的反应热之间的关系为ΔH=ΔH1+ΔH2;因为反应2NO(g)+O2(g)![]() 2NO2(g)为①+②的结果,所以其平衡常数K= K1K2;反应慢的速率决定总反应速率,则决定2NO(g)+O2(g)
2NO2(g)为①+②的结果,所以其平衡常数K= K1K2;反应慢的速率决定总反应速率,则决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率的是反应②,所以所以反应①的活化能E1远小于反应②的活化能E2;
2NO2(g)的反应速率的是反应②,所以所以反应①的活化能E1远小于反应②的活化能E2;
故答案为:ΔH=ΔH1+ΔH2;K= K1·K2;②;<;
(3)①设0~20 min内生成N2O4的物质的量是x mol。
2NO2(g)![]() N2O4(g)
N2O4(g)
开始(mol/L): 0.2 0
转化(mol/L): x ![]()
20 min(mol/L):(0.2x) ![]()
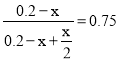 ,解得:x = 0.08,v(N2O4) =
,解得:x = 0.08,v(N2O4) = ![]() mol/L÷20 min = 2.0×103 mol/(L·min);
mol/L÷20 min = 2.0×103 mol/(L·min);
②设平衡时N2O4的浓度为x mol/L。
2NO2(g)![]() N2O4(g)
N2O4(g)
开始: 0.2 mol/L 0
转化: 2x mol/L x mol/L
平衡: (0.22x) mol/L x mol/L
![]() ,x=0.075,v正(NO2)∶v逆(N2O4)=2∶1,即
,x=0.075,v正(NO2)∶v逆(N2O4)=2∶1,即
故答案为:2.0×103;k1=60k2;>。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g),反应过程如下图所示,下列说法正确的是
2NH3(g),反应过程如下图所示,下列说法正确的是

A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,下列说法正确的是( )

A. 反应体系中I2和Fe2+可循环使用
B. 光电池是原电池
C. 光催化反应池中的反应方程式为:2I—+2Fe3+ ![]() I2+2Fe2+
I2+2Fe2+
D. 进入电解池B的溶液与从电解池B排出的溶液pH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Fe3++ Ag ![]() Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
Fe2+ + Ag+ ,可用Fe3+的盐溶液做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是_____________________________(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是_______(填序号)。
a.c(Fe3+)减小 b.c(Cl-)不变 c .铁元素质量减小
(3)乙同学欲从洗银废液(Fe3+、 Fe2+、 Ag+、 NO3-)中回收银和刻蚀液,设计了如下路线:

①过程Ⅰ中反应的离子方程式是_______________________、_____________________。
②过程Ⅱ中加入的试剂可以是_______________。
(4)镀银后的银氨溶液(Ag(NH3)2OH)放置时会析出有强爆炸性的物质,所以不能贮存。从银氨溶液中回收银的方法是:向银氨溶液中加入过量盐酸,过滤,向沉淀AgCl中加入羟氨(NH2OH),充分反应后可得银,羟氨被氧化为N2。
①生成AgCl沉淀的化学方程式是_____________________。
②若该反应中消耗3.3 g羟氨,理论上可得银的质量为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入盛饱和澄清石灰水的烧杯里,不可能观察到的现象是
A.钠熔成小球并在液面上游动
B.溶液底部有银白色物质生成
C.有气体生成
D.溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠电池由于其快速充放电的特性受到科研工作者的重视,某钠离子钛基电池电池结构如图所示,电解质为含钠离子的高聚物,已知电池的反应方程式为2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是
2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是

A. 放电时电池正极为NaxCn B. 放电时Na+向电极Ⅱ移动
C. 充电时阳极反应:NaxCn-xe-=nC+xNa+ D. 充电时电极Ⅰ与外电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国政府承诺到2020年单位GDP二氧化碳排放比2005年下降40%~45%。CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
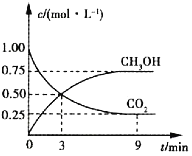
(1)3~9min内,v(H2)=_______mol·L-1·min-1。
(2)平衡时CO2的转化率为______。
(3)平衡时混合气体中CH3OH(g)的体积分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
A.1:1B.2:1C.3:1D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com