
【题目】利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,下列说法正确的是( )

A. 反应体系中I2和Fe2+可循环使用
B. 光电池是原电池
C. 光催化反应池中的反应方程式为:2I—+2Fe3+ ![]() I2+2Fe2+
I2+2Fe2+
D. 进入电解池B的溶液与从电解池B排出的溶液pH相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 天然植物油常温下一般呈液态,难溶于水,熔点、沸点比动物脂肪低
B. 葡萄糖有醛基,果糖不含醛基,故二者可用银镜反应鉴别
C. 若两种二肽互为同分异构体,则二者的水解产物可能相同,也可能不同
D. 含5个碳原子的有机物,每个分子中最多可形成4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:![]()
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3:4,与A相关的反应如下:
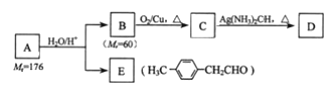
请回答下列问题:
(1)A的分子式为__,B的名称是__;
(2)写出C→D反应的化学方程式:__;
(3)链烃M的相对分子质量比B多24,分子中所有碳原子均在同一平面上,其结构简式是__;
Ⅱ.由E转化为对甲基苯乙炔(![]() )的一条路线如下:
)的一条路线如下:

(4)①反应中所加试剂是__; ③的反应类型是__;
(5)写出G的结构简式:__;
(6)写出两种同时符合下列条件的E的同分异构体的结构简式:__。
①属于芳香醛;
②苯环上有两种不同环境的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离或除杂的方法正确的是
A.分离硬脂酸钠和甘油,加饱和食盐水盐析,过滤
B.除去乙酸乙酯中的乙酸,加烧碱溶液,蒸馏
C.分离苯酚和酒精混合液,分液
D.除去淀粉溶液中NaCl,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在酸性溶液中能大量共存且溶液呈无色透明的是
A.K+、Na+、SiO32-、Br-B.Na+、K+、CH3COO-、NO3-
C.K+、Cl-、Fe3+、SO42-D.Mg2+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出分子式为C3H5Cl且含碳碳双键的所有同分异构体_______________________。
(2)有机物w分子式为C4H6,且其等效氢只有一种,请写出w所有的结构简式______________。
(3)已知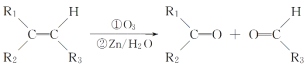 ,某含四元环的有机物发生这个反应后,得到
,某含四元环的有机物发生这个反应后,得到![]() 和
和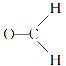 各1mol,请写出该有机物的结构简式_____________。
各1mol,请写出该有机物的结构简式_____________。
(4)已知![]() +NaOH
+NaOH![]() R—CH=CH2+NaCl+H2O请设计由乙烯制备乙炔的方案,无机试剂任意选择,用如下流程图表示反应的流程
R—CH=CH2+NaCl+H2O请设计由乙烯制备乙炔的方案,无机试剂任意选择,用如下流程图表示反应的流程
如:CH3-CH3![]() CH3-CH2Cl
CH3-CH2Cl
______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素是植物生长的必需元素,含氮化合物在工农业生产以及生活中都发挥着重要作用。
(1)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为____。
(2)氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。某化学课外小组查阅资料后得知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快)ΔH1<0 K1
N2O2(g)(快)ΔH1<0 K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0 K2
2NO2(g)(慢)ΔH2<0 K2
反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)
2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
(3)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,v(N2O4)=__________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为____。改变温度至T1时k1=k
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com