
【题目】钠电池由于其快速充放电的特性受到科研工作者的重视,某钠离子钛基电池电池结构如图所示,电解质为含钠离子的高聚物,已知电池的反应方程式为2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是
2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是

A. 放电时电池正极为NaxCn B. 放电时Na+向电极Ⅱ移动
C. 充电时阳极反应:NaxCn-xe-=nC+xNa+ D. 充电时电极Ⅰ与外电源正极相连
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在酸性溶液中能大量共存且溶液呈无色透明的是
A.K+、Na+、SiO32-、Br-B.Na+、K+、CH3COO-、NO3-
C.K+、Cl-、Fe3+、SO42-D.Mg2+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲、乙、丙为组成生物体的相关化合物,乙为一个由α、β、γ三条多肽链形成的蛋白质分子,共含271个氨基酸,图中每条虚线表示由两个硫基(-SH)脱氢形成一个二硫键(-S-S-)。下列相关叙述不正确的是

A. 甲为组成乙的基本单位,且乙中最多含有20种甲
B. 由不同的甲形成乙后,相对分子质量比原来少了4 832
C. 丙主要存在于细胞核中,且在乙的生物合成中具有重要作用
D. 如果甲中的R为C3H5O2,则由两分子甲形成的化合物中含有16个H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N元素是植物生长的必需元素,含氮化合物在工农业生产以及生活中都发挥着重要作用。
(1)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为____。
(2)氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。某化学课外小组查阅资料后得知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快)ΔH1<0 K1
N2O2(g)(快)ΔH1<0 K1
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)ΔH2<0 K2
2NO2(g)(慢)ΔH2<0 K2
反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)
2NO2(g)的ΔH=__(用含ΔH1和ΔH2的式子表示),K=___(用含K1和K2的式子表示)。决定2NO(g)+O2(g)![]() 2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
2NO2(g)的反应速率的是反应_____(填序号),则反应①的活化能E1,与反应②的活化能E2的大小关系为E1___(填“>”“<”或“=”)E2。
(3)在373 K时,向体积为2 L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0 kJ·mol1。测得NO2的体积分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,v(N2O4)=__________。
②上述反应中,v正(NO2)=k1·c2(NO2),v逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373 K时,k1、k2的数学关系式为____。改变温度至T1时k1=k
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
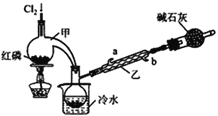
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
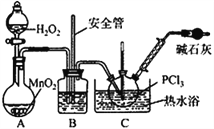
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛工厂TiCl4烟尘中含有大量的ScCl3、MgCl2及SiO2小颗粒等物质,某研究所利用上述烟尘回收Sc2O3,并制备钛白粉(TiO2),其工艺流程如下所示:

(1)酸浸过程中,HCl的作用是_______________________。
(2)已知Sc3++3HTBP![]() Sc(TBP)3+3H+,则上述洗脱剂最好选择___________(选填“酸性”、“碱性”或“中性”)溶液。在实验室模拟完成上述操作Ⅰ和操作Ⅱ所涉及的玻璃仪器有______________。
Sc(TBP)3+3H+,则上述洗脱剂最好选择___________(选填“酸性”、“碱性”或“中性”)溶液。在实验室模拟完成上述操作Ⅰ和操作Ⅱ所涉及的玻璃仪器有______________。
(3)草酸“沉钪”得到草酸钪的化学反应类型为____________________________。
(4)在空气中灼烧草酸钪即可得到氧化钪(Sc2O3),其化学反应方程式为__________________________。
(5)“水相”的主要离子有TiOCl42-、H+、Cl- 及________,写出加入大量的水并加热发生的相关离子反应方程式__________________________。
(6)钛的冶炼新法是剑桥电解法(如右图)。
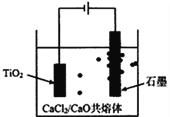
以含少量CaCl2的CaO熔融物作为介质,电解时。在阴极生成的Ca进一步还原TiO2得钛。写出阳极电极主要反应方程式:__________________________;利用中学所学知识可以预测CaCl2的作用包含增强导电性、___________;F=96500C/mol,当I=0.5A,通电80分钟,理论上获得Ti的质量为__________g(计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应N2+3H2![]() 2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
2NH3,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:

回答下列问题:
(1)处于平衡状态的时间段是__________(填选项)。
A.t0~t1 B.t1~t2 C.t2~t3
D.t3~t4 E.t4~t5 F.t5~t6
(2) t1、t3、t4时刻分别改变的一个条件是(填选项)。
A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻__________;t3时刻__________;t4时刻__________。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是______(填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。_______
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
2CO2(g)+N2(g) ΔH = a kJ·mol-1。为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一定容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如下表(CO2和N2的起始浓度均为0)。
时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是_______反应(填“放热”或“吸热”)。
(2)前3s内的平均反应速率υ(N2)=___________,t1℃时该反应的平衡常数K=________。
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是_______。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(4)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
则处理汽车尾气反应中的a=__________。
(5)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g) ![]() CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
CO2(g)+N2(g) ΔH4。向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,有关数据如下表:
NO | N2 | CO2 | |
起始浓度/mol·L-1 | 0.10 | 0 | 0 |
平衡浓度/mol·L-1 | 0.04 | 0.03 | 0.03 |
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则ΔH4_______0(填“ >”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com