
����Ŀ���ѹ���TiCl4�̳��к��д�����ScCl3��MgCl2��SiO2С���������ʣ�ij�о������������̳�����Sc2O3�����Ʊ��Ѱ�(TiO2)���乤������������ʾ��

��1�����������HCl��������_______________________��
��2����֪Sc3++3HTBP![]() Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��___________(ѡ����ԡ��������ԡ������ԡ�)��Һ����ʵ����ģ���������������Ͳ��������漰�IJ���������______________��
Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��___________(ѡ����ԡ��������ԡ������ԡ�)��Һ����ʵ����ģ���������������Ͳ��������漰�IJ���������______________��
��3�����ᡰ���֡��õ������ֵĻ�ѧ��Ӧ����Ϊ____________________________��
��4���ڿ��������ղ����ּ��ɵõ�������(Sc2O3)���仯ѧ��Ӧ����ʽΪ__________________________��
��5����ˮ�ࡱ����Ҫ������TiOCl42-��H+��Cl- ��________��д�����������ˮ�����ȷ�����������ӷ�Ӧ����ʽ__________________________��
��6���ѵ�ұ���·��ǽ��ŵ�ⷨ������ͼ����
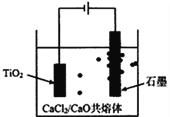
�Ժ�����CaCl2��CaO��������Ϊ���ʣ����ʱ�����������ɵ�Ca��һ����ԭTiO2���ѡ�д�������缫��Ҫ��Ӧ����ʽ��__________________________��������ѧ��ѧ֪ʶ����Ԥ��CaCl2�����ð�����ǿ�����ԡ�___________��F=96500C/mol����I=0.5A��ͨ��80���ӣ������ϻ��Ti������Ϊ__________g���������ʽ����
���𰸡�����TiOCl42-�Ľ�һ��ˮ�⣨���Mg2+��Sc3+ˮ������֣� ���� ��Һ©�����ձ� ���ֽⷴӦ 3O2+2Sc2��C2O4��3![]() 2Sc2O3+12CO2 Mg2+ TiOCl42-+��1+x��H2O
2Sc2O3+12CO2 Mg2+ TiOCl42-+��1+x��H2O![]() TiO2��xH2O+2H++4Cl- 2O2--4e-=O2�� ����CaO���۵�
TiO2��xH2O+2H++4Cl- 2O2--4e-=O2�� ����CaO���۵� ![]()
��������
(1)Ϊ�˷�ֹTiOCl42-��Mg2+��Se3+ˮ�⣬��������м���HCl���ԣ��ʴ�Ϊ������TiOCl42-�Ľ�һ��ˮ�⣻
(2)����Sc3++3HTBP![]() Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��������Һϴ�ӣ���������Sc3+��HTBP�ķ�Ӧ��������Ͳ�����Ϊ��Һ�����漰�IJ��������з�Һ©�����ձ����ʴ�Ϊ�����ԣ���Һ©�����ձ���
Sc(TBP)3+3H+��������ϴ�Ѽ����ѡ��������Һϴ�ӣ���������Sc3+��HTBP�ķ�Ӧ��������Ͳ�����Ϊ��Һ�����漰�IJ��������з�Һ©�����ձ����ʴ�Ϊ�����ԣ���Һ©�����ձ���
(3)ScCl3����ᷢ�����ֽⷴӦ���ɲ����֣��ʴ�Ϊ�����ֽⷴӦ��
(4)�ڿ��������ղ����ּ��ɵõ�������(Sc2O3)��ͬʱ��������ӱ��������ɶ�����̼����Ӧ�Ļ�ѧ��Ӧ����ʽΪ3O2+2Sc2(C2O4)3![]() 2Sc2O3+12CO2���ʴ�Ϊ��3O2+2Sc2(C2O4)3
2Sc2O3+12CO2���ʴ�Ϊ��3O2+2Sc2(C2O4)3![]() 2Sc2O3+12CO2��
2Sc2O3+12CO2��
(5)��������ͼ���ѹ���TiCl4�̳��к��д�����ScCl3��MgCl2��SiO2С���������ʣ�������˳�ȥ�˶������裬�����л��ܼ���ȡ����ˮ��������Ҫ������TiOCl42-��H+��Cl-��Mg2+����ˮ���м��������ˮ�����ȴٽ�TiOCl42-ˮ������TiO2��xH2O����Ӧ�����ӷ���ʽΪTiOCl42-+(1+x)H2O![]() TiO2��xH2O+2H++4Cl-���ʴ�Ϊ��Mg2+��TiOCl42-+(1+x)H2O
TiO2��xH2O+2H++4Cl-���ʴ�Ϊ��Mg2+��TiOCl42-+(1+x)H2O![]() TiO2��xH2O+2H++4Cl-��
TiO2��xH2O+2H++4Cl-��
(6)�������������Ʊ���ԭ����Ca������ԭ��Ca��һ����ԭTlO2����ѣ��缫��ӦΪCa2++2e-=Ca��2Ca+TlO2=2CaO+Ti������ʯī��������ʧȥ���������������缫��ӦʽΪ2O2--4e-=O2���������Ϊ�����Ȼ��Ƶ����ڵ������ƣ������Ȼ��ƿ�����ǿ����ʵĵ����ԣ�ͬʱ���Խ���CaO���۵㣬��Լ����������ǿ��Ϊ0.5A����ع���80���ӣ������Ϊ0.5A��80��60s=2400C��ת�Ƶ��ӵ����ʵ���=![]() ������Ti������=
������Ti������=![]() ��48g/mol=
��48g/mol=![]() ��48g���ʴ�Ϊ��2O2--4e-=O2��������CaO���۵㣻
��48g���ʴ�Ϊ��2O2--4e-=O2��������CaO���۵㣻![]() ��48��
��48��


 ��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
��ͼͼ�麮����ҵ������ҵ���ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̫����Ϊ��Դ���Ȼ�ѧ���ѭ���ֽ�ˮ��һ�ָ�Ч�����������ⷽ����������ͼ���£�

��ط�Ӧ���Ȼ�ѧ����ʽΪ��
��ӦI��SO2(g) + I2(g) + 2H2O(l) === 2HI(aq) + H2SO4(aq) ��H1 =��213 kJ��mol-1
��ӦII��H2SO4(aq) === SO2(g) + H2O(l) + ![]() O2(g) ��H2 = +327 kJ��mol-1
O2(g) ��H2 = +327 kJ��mol-1
��ӦIII��2HI(aq) === H2(g) + I2(g) ��H3 = +172 kJ��mol-1
����˵������ȷ���ǣ�
A. �ù���ʵ����̫���ܵ���ѧ�ܵ�ת��
B. SO2��I2���ܷ�Ӧ���˴���������
C. �ܷ�Ӧ���Ȼ�ѧ����ʽΪ��2H2O(l) === 2H2 (g)+O2(g) ��H = +286 kJ��mol-1
D. �ù��̽�����ˮ�ֽ����ⷴӦ�Ļ�ܣ����ܷ�Ӧ����H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�ӦFe3+�� Ag ![]() Fe2+ �� Ag+ ������Fe3+������Һ����ʴҺ���Թ��е�����ϴȥ��
Fe2+ �� Ag+ ������Fe3+������Һ����ʴҺ���Թ��е�����ϴȥ��
��1��FeCl3��Һ�����ԣ�ԭ����_____________________________�������ӷ���ʽ��ʾ����
��2������FeCl3��Һϴ��������������ȷ����_______������ţ���
a��c��Fe3+����С��������b��c��Cl-�����䡡����c ����Ԫ��������С
��3����ͬѧ����ϴ����Һ��Fe3+�� Fe2+�� Ag+�� NO3-���л������Ϳ�ʴҺ�����������·�ߣ�

�ٹ��̢��з�Ӧ�����ӷ���ʽ��_______________________��_____________________��
�ڹ��̢��м�����Լ�������_______________��
��4���������������Һ��Ag��NH3��2OH������ʱ��������ǿ��ը�Ե����ʣ����Բ������档��������Һ�л������ķ����ǣ���������Һ�м���������ᣬ���ˣ������AgCl�м����ǰ���NH2OH������ַ�Ӧ��ɵ������ǰ�������ΪN2��
������AgCl�����Ļ�ѧ����ʽ��_____________________��
�����÷�Ӧ������3��3 g�ǰ��������Ͽɵ���������Ϊ_______g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƶ����������ٳ�ŵ�������ܵ����й����ߵ����ӣ�ij�������ѻ���ص�ؽṹ��ͼ��ʾ�������Ϊ�������ӵĸ߾����֪��صķ�Ӧ����ʽΪ2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3�����й��ڸõ��˵����ȷ����
2nC+ xNa3Ti2(PO4)3�����й��ڸõ��˵����ȷ����

A. �ŵ�ʱ�������ΪNaxCn B. �ŵ�ʱNa+��缫���ƶ�
C. ���ʱ������Ӧ��NaxCn-xe-=nC+xNa+ D. ���ʱ�缫�������Դ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�������ŵ��2020�굥λGDP������̼�ŷű�2005���½�40%~45%��CO2��ת�����л���ʵ��̼ѭ���������Ϊ1L���ܱ������г���1molCO2��3molH2��һ�������·�����Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
CH3OH(g)+H2O(g)�����CO2��CH3OH(g)��Ũ����ʱ��ı仯��ͼ��ʾ��
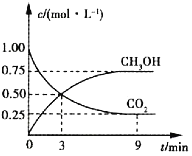
��1��3~9min�ڣ�v(H2)=_______mol��L-1��min-1��
��2��ƽ��ʱCO2��ת����Ϊ______��
��3��ƽ��ʱ���������CH3OH(g)���������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ������Ҫ��SO2�йص���
A. �����ն� B. ������γ� C. �⻯ѧ���� D. ����ЧӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ������Ƭ����һ�����������ᷴӦ���ڶ����������ռ���Һ��Ӧ��ͬ��ͬѹ�·ų���ͬ��������壬�����ĵ�HCl��NaOH�����ʵ���֮��Ϊ�� ��
A.1��1B.2��1C.3��1D.1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��Ϊԭ����ȡ������þ������ӡȾ����ֽ��ҽҩ�ȹ�ҵ����þ����һ�ֹ�ҵ���ϣ���Ҫ�ɷ���MgO(ռ40%)������CaO��MnO��Fe2O3��FeO��Al2O3��SiO2�����ʡ�����þ������ȡMgSO4��7H2O���������£�

(1)ʵ��������3 mol��L��1������500 mL������98%��Ũ����(����1.84 g��mL��1)�����ƣ���ȡŨ����ʱ����ʹ�õ���Ͳ�Ĺ��Ϊ ________(����ĸ)��
A��10 mL B��20 mL C��50 mL D��100 mL
(2)�����NaClO����Mn2����Ӧ������ʽΪMn2����ClO����H2O===MnO2����2H����Cl��,
��ʹ2moL Mn2����������������Ҫ������NaClO����Ϊ______g;����һ������Ҳ�ᱻNaClO�������÷�Ӧ�����ӷ���ʽΪ______________________________________��
(3)��������Ҫ�ɷֳ�����Fe(OH)3��Al(OH)3�⣬������________��_________��
(4)�ڡ����ơ�����ǰ����Ҫ������Һ���Ƿ���Fe2�����������鷽����_____________________________________��
(5)��֪MgSO4��CaSO4���ܽ�����±�(�ܽ�ȵ�λΪg/100 gˮ)��
�¶�/�� | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
�����ơ��ǽ�MgSO4��CaSO4�����Һ�е�CaSO4��ȥ�������ϱ����ݣ���Ҫ˵�����ƵIJ������裺����Ũ����_________�����������ǽ���Һ��������Ũ������ȴ�ᾧ��__________����õ���MgSO4��7H2O��
(6)��ʵ�����ṩ����þ�100 g���õ���MgSO4��7H2OΪ86.1 g����MgSO4��7H2O�IJ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ��̽���������Ļ����ԣ������ͼ��ʾװ�ã������ƶϺ������ǣ� ��
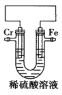
A. �����������ã�����Ӿ����·�����缫������缫
B. �����ȸ����ã�����Һ��H+�����缫Ǩ��
C. �����������ã������缫��ӦʽΪ2H����2e����H2��
D. �����缫������ҺpH���������ȸ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com