
����Ŀ��ijͬѧ̽��ͬ��������Ԫ�����ʵݱ����ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ������![]() ���±������е���ʵ�鷽��������ʵ��������ǰ��һ���Ƕ�Ӧ��ϵ
���±������е���ʵ�鷽��������ʵ��������ǰ��һ���Ƕ�Ӧ��ϵ![]() ��
��
ʵ�鲽�� | ʵ������ |
| A.����ˮ���ϣ��۳�С�����������˶�����֮��ʧ����Һ��ɺ�ɫ�� |
| B.�������������Һ���dz��ɫ |
| C.���ҷ�Ӧ��Ѹ�ٲ���������ɫ���� |
| D.��Ӧ��ʮ�־��ң�������ɫ���� |
| E.���ɵ���ɫ���� |
���������ͬѧ���������ʵ�鱨�档
(1)ʵ��Ŀ�ģ� ______ ��
(2)ʵ����Ʒ���Լ��������ƣ�þ����������ϡ���ᣬ������ˮ������![]() ��Һ�ȣ��������� ______ ���� ______ ���� ______ ���ԹܼУ����ӣ�С��������Ƭ��ɰֽ���ƾ��Ƶȡ�
��Һ�ȣ��������� ______ ���� ______ ���� ______ ���ԹܼУ����ӣ�С��������Ƭ��ɰֽ���ƾ��Ƶȡ�
(3)ʵ�����ݣ�![]() ��д��ʵ�鲽���Ӧ��ʵ������ı�ź����ӷ���ʽ
��д��ʵ�鲽���Ӧ��ʵ������ı�ź����ӷ���ʽ![]() _______________________
_______________________
ʵ������ | ʵ������ | ���ӷ���ʽ |
1 | ||
2 | ||
3 | ||
4 | ||
5 |
(4)��������������ˮ����ļ������ǿ������֤Mg��Alʧ�������������ǿ�����������ʵ��![]() ʵ����Ʒ��ѡ����Ҫ��д��ѧ����ʽ
ʵ����Ʒ��ѡ����Ҫ��д��ѧ����ʽ![]() �� ______ ��
�� ______ ��
(5)ʵ����ۣ� ______ ��
���𰸡�̽��ͬһ��������Ԫ�����ʵĵݱ���� �ձ� �Թ�
ʵ������ | ʵ������ | ���ӷ���ʽ |
1 | B |
|
2 | E |
|
3 | A |
|
4 | C |
|
5 | D |
|
��ͷ�ι� ����Һ�еμ�NaOH��Һ���������ð�ɫ���������ܽ⣻����Һ�еμ�NaOH��Һ��������������ɫ��״�������̶�������ʧ ͬ����Ԫ����ԭ����������Ԫ�ؽ������������ǽ���������ǿ
��������
(1)����ʵ�鷽����֪ʵ��Ŀ�ģ��٢ۢܢ���ͬһʵ��Ŀ�ģ��ڿ�˵����һʵ��Ŀ�ģ�
(2)����ʵ��������ʵ��ҩƷ�����ʽ��ʵ������ж�����������
(3)����ʵ���������ж�ʵ�鷽���������Ļ�ѧ��Ӧ��
(4)����������þ�������������Ʒ�Ӧ���������������������Ʒ�Ӧ�����
(5)����ʵ������ȽϽ����ԡ��ǽ����Ե�ǿ��������ʵ��Ľ��ۣ�
(1)��ʵ�鷽���٢ۢܢݿ���֤�����Ļ����ԣ��ڿ���֤�ǽ����Ļ����ԣ���ʵ��Ŀ��Ϊ֤��ͬ����Ԫ�ؽ����ԣ��ǽ����Եݱ����(��֤����������Ԫ�ؽ����ԣ��ǽ������Եݱ���ɻ�֤��Na��Mg��Al������ǿ����S��Cl�ǽ�����ǿ��)�� �ʴ�Ϊ��̽��ͬһ��������Ԫ�����ʵĵݱ���ɣ�
(2)������з�̪��Һ����ˮ��Ӧ��һ��Ӧ���ձ��н��У���þ����������2mol/L�����ᷴӦ��һ��Ҫ���Թ��н��У������Ƶõ�Na2S��Һ�еμ��������Ƶ���ˮ����Ҫ��ͷ�ιܣ� �ʴ�Ϊ���ձ����Թܣ���ͷ�ιܣ�
(3)��A����ˮ���ϣ��۳�С�����������˶�����֮��ʧ����Һ��ɺ�ɫ��֪���������Ӧ����![]() ������з�̪��Һ����ˮ��Ӧ�����ӷ�ӦΪ��
������з�̪��Һ����ˮ��Ӧ�����ӷ�ӦΪ��![]() ��
��
��B�������������Һ���dz��ɫ��֪���������Ӧ�ķ���Ϊ![]() ��ɰֽ��ĥ���þ�����ˮ��Ӧ������ӦҺ�еμӷ�̪�����ӷ�ӦΪ��
��ɰֽ��ĥ���þ�����ˮ��Ӧ������ӦҺ�еμӷ�̪�����ӷ�ӦΪ��![]() ��
��
��C��Ӧ��ʮ�־��ң�������ɫ���壬�������Ӧ�ķ���Ϊ![]() ������Ͷ��ϡ�����У����ӷ�ӦΪ��
������Ͷ��ϡ�����У����ӷ�ӦΪ��![]() ��
��
��D���ҷ�Ӧ������������ɫ�����֪���������Ӧ�ķ���Ϊ![]() ��þ��Ͷ��ϡ�����У����ӷ�ӦΪ��
��þ��Ͷ��ϡ�����У����ӷ�ӦΪ��![]() ��
��
��E���ɵ���ɫ������֪���������Ӧ�ķ���Ϊ![]() �����Ƶõ�Na2S��Һ�еμ��������Ƶ���ˮ�����������ӷ�ӦΪ��
�����Ƶõ�Na2S��Һ�еμ��������Ƶ���ˮ�����������ӷ�ӦΪ��![]() ��
��
�ʴ�Ϊ��
ʵ������ | ʵ������ | ���ӷ���ʽ |
1 | B |
|
2 | E |
|
3 | A |
|
4 | C |
|
5 | D |
|
(4)������þ�������������Ʒ�Ӧ���������������������Ʒ�Ӧ��˵��������þ���Դ���������������������Һ�еμ�NaOH��Һ���������ð�ɫ���������ܽ⣻����Һ�еμ�NaOH��Һ��������������ɫ��״�������̶�������ʧ��
�ʴ�Ϊ������Һ�еμ�NaOH��Һ���������ð�ɫ���������ܽ⣻����Һ�еμ�NaOH��Һ��������������ɫ��״�������̶�������ʧ��
(5)��ʵ���֪������Na��Mg��Al���ǽ�����Cl��S����ʵ�����Ϊͬ����Ԫ����ԭ����������Ԫ�ؽ������������ǽ���������ǿ�� �ʴ�Ϊ��ͬ����Ԫ����ԭ����������Ԫ�ؽ������������ǽ���������ǿ��


 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���к��ȵIJⶨʵ���У�������������ҺѸ�ٵ���ʢ����������ȼ��У�������������¼��Һ����ʼ�¶ȣ���ַ�Ӧ���ٶ�������¼��Ӧ��ϵ������¶�
B.500����30MPa�£���0.5molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) H=-38.6kJ/mol
2NH3(g) H=-38.6kJ/mol
C.�ֹ��ȼƿ��������ⶨijЩ��ѧ��Ӧ�ķ�Ӧ����
D.����ı�ȼ����Ϊ890.3kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(g) H=-890.3kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. C2H5OH(l)��3O2(g)��2CO2(g)��3H2O(g) ��H=��1234.8kJ��mol��1
���ۣ�C2H5OH��ȼ���� ��H=��1234.8 kJ��mol��1
B. ϡ��Һ����H��(aq)��OH��(aq)��H2O(l) ��H����57.3 kJ��mol��1
���ۣ���ϡ������NaOH��ϡ��Һ��Ϻ�����1 mol H2O���ɣ���ų�����������57.3kJ
C. C(s,ʯī)��C(s,���ʯ) ��H=��1.5kJ��mol��1
���ۣ���ͬ�����½��ʯ��ʯī�ȶ�
D. Sn(s,��)![]() Sn(s,��) ��H=��2.1kJ��mol��1(����Ϊ��ĩ״)
Sn(s,��) ��H=��2.1kJ��mol��1(����Ϊ��ĩ״)
���ۣ�����Ʒ�ں���Ķ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ǵؿ��к�����Ϊ�ḻ�ķǽ���Ԫ�أ���Ҫ��������ˮ����������Ca3��PO4��2����ʽ���ڡ����ĵ��ʺͻ������ڹ�ũҵ������������Ҫ��Ӧ�á�
���ף�P4������Ca3��PO4��2����̿��SiO2��һ�������·�Ӧ��á�����Ȼ�ѧ����ʽ���£�
2Ca3��PO4��2��s��+10C��s���T6CaO��s��+P4��s��+10CO��g����H1��+3359.26 kJmol��1
CaO��s��+SiO2��s���TCaSiO3��s����H2����89.61 kJmol��1
д�����ף�P4����Ca3��PO4��2����̿��SiO2��һ�������·�Ӧ���Ȼ�ѧ����ʽΪ��_____��
��2�����ӹ�ҵ����ϴ��Ƭ�ϵ�SiO2��s���ķ�ӦΪSiO2��s��+4HF��g���TSiF4��g��+2H2O��g����H��298.15 K������94.0 kJmol��1��S��298.15 K������75.8 Jmol��1K��1�����H�͡�S�����¶ȶ��仯���˷�Ӧ�Է����е��¶���_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ����ú�ˮ��Դ�����Ʊ��Ȼ�李��������þ�����ʣ����������£�

��1����Ӧ�������У�����������ԭ��Ӧ����______________������ţ���
��2��д����Ӧ�ڵ����ӷ���ʽ__________________________________________________��
��3��X��Һ�е���Ҫ��������Na+��____________��
��4�������к���Na2SO4��MgCl2��CaCl2�����ʣ�Ϊ�Ƶô�����NaCl���壬�������£����ܽ⣻�����μ��������BaCl2��Һ��NaOH��Һ��Na2CO3��Һ����_____���ܼ����������_____���벹ȫȱ�ٵ�ʵ�鲽�裩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
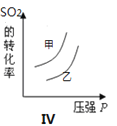
����Ŀ�����ݻ�������ܱ������д������·�Ӧ2SO2(g)��O2(g) ![]() 2SO3(g) ��H ��0��ijѧϰС���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���� ( )
2SO3(g) ��H ��0��ijѧϰС���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���� ( )
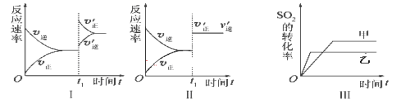
A.ͼ���ʾ����t1ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B.ͼ���ʾ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
C.ͼ���ʾ����ѹǿ�Ի�ѧƽ���Ӱ�죬���ҵ�ѹǿ�ϸ�
D.ͼIV��ʾ�����¶ȡ�ѹǿ��ƽ���Ӱ�죬�Ҽ��¶ȱ��ҵĸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ��̽��þ��Ũ����ķ�Ӧ����ͬѧ��Ϊ�����������Ƕ�������������ͬѧ��Ϊ�������������������ܲ���������Ϊ��֤�ס�����ͬѧ���ж��Ƿ���ȷ����ͬѧ��Ƶ�ʵ��װ����ͼ��ʾ��þ����Ũ���Ṳ��ʱ����������ΪX���Ҹ����巢��װ������ȥ����

��1������E��������_____________��
��2��þ����Ũ���Ṳ��ʱ���ɶ�������Ļ�ѧ����ʽΪ_____________��
��3����ͬѧ��Ϊ�����ܲ���������������_____________��
��4��B �м�����Լ���_______����������_____________��
��5��װ��A�з�����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�������ݣ�
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm��3 |
�Ҵ� | ��144 | 78.0 | 0.789 |
���� | 16.6 | 118 | 1.05 |
�������� | ��83.6 | 77.5 | 0.900 |
Ũ����(98%) | �� | 338 | 1.84 |
��ͼΪʵ������ȡ����������װ��ͼ��

��1��������̼������Һ�Ϸ��ռ����϶�Һ��ʱ��ֹͣ���ȣ�ȡ��С�Թ�B����������á���ǰ���ʵ������Ϊ________(����ĸ)��
A���ϲ�Һ��䱡 B���²�Һ���ɫ��dz���Ϊ��ɫ C����������� D���й���ζ
��2��Ϊ���������������Ҵ�������Ļ����ɰ����в�����з��룺

���Լ�1���ѡ��_________________________________________________��
�ڲ���1��________�����õ���Ҫ����������__________________________��
���Լ�2���ѡ��_____________________________________��
�ܲ���2��_______________________________________��
�ݲ���3���¶ȼ�ˮ�����λ��ӦΪ��ͼ��________(�a����b����c����d��)��ʾ���ڸò����У���������ƿ���¶ȼ��� ����ƿ ������Ҫ�IJ���������__________��________��________���ռ�����������¶���________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ�������,һ�������½��з�Ӧ:NO(g)+CO(g)=1/2N2(g)+CO2(g)����H=-373.2 kJ/mol����ͼ����a��ʾ�÷�Ӧ������,NO��ת�����뷴Ӧʱ��Ĺ�ϵ,���ı���ʼ����,ʹ��Ӧ���̰�������b����,�ɲ�ȡ�Ĵ�ʩ��(����)

A. �Ӵ��� B. ���ܱ������м������
C. �����¶� D. ����Ӧ����NO��Ũ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com