
【题目】以NaClO为有效成分的“84”消毒液在抗击新冠疫情的消杀工作中起到了重要作用。某研究小组设计下列实验探究NaClO的性质。
(已知:电离常数:![]() :
:![]() ,
,![]() ;
;![]() )
)
实验 | 装置 | 试剂(少量) | 预测可能的现象 |
① |
| 酚酞 | 无色溶液最终呈红色 |
② |
| 无明显现象 | |
③ | 淀粉 | 无色溶液立即变蓝 | |
④ |
| 溶液略呈浅绿色 |
结合上述实验探究,预测的现象以及解释均正确的是( )
A.实验①:NaClO溶液呈碱性:![]()
B.实验②:NaClO可用于制得![]()
C.实验③:NaClO具有氧化性:![]()
D.实验④:NaClO具有还原性:![]()
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】甲醇是未来重要的绿色能源之一。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ、CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0KJ/mol
Ⅱ、CO(g)+2H2(g)═CH3OH(g) △H=﹣129.0KJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为___。
(2)将1.0molCH4和2.0mol H2O(g)通入容积为2L的密闭容器中,在一定条件下发生反应I,测得在一定压强下平衡时CH4的转化率与温度的关系如图1。

①假设100℃时反应I达到平衡所需的时间为5min,则用H2表示这段时间该反应的平均反应速率为___。
②100℃时反应I的平衡常数为___。若保持温度和容器的容积不变,5min时再向容器中充入H2O(g)和CO各0.2mol,平衡将___移动(填“正向”、“逆向”或“不”)。
(3)如图2,P是可自由平行滑动的活塞,关闭K2,在相同温度下,通过K1、K3分别向A、B中各充入2mol CO和3molH2,在一定条件下发生反应Ⅱ,关闭K1、K3,反应起始时A、B的体积相同,均为aL。
①反应达到平衡后,A内压强为起始压强的![]() ,则平衡时A容器中H2的体积分数为__。
,则平衡时A容器中H2的体积分数为__。
②若在平衡后打开K2,再次达到平衡后B容器的体积缩至0.6aL,则打开K2之前,B容器的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容,引起了人们的研究兴趣。
(1)现有以下三种乙醇燃料电池(DEFC)。

①碱性乙醇燃料电池中,电极a上发生的电极反应式为____。
②酸性乙醇燃料电池中,电极b上发生的电极反应式为___。
③熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电极b上发生的电极反应式为___。
(2)0.4mol CuSO4和0.4molNaCl溶于水,配成1L溶液,用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为___L。
(3)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示,则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】味精的成分为谷氨酸钠。用丙烯合成谷氨酸钠的一种方案如下:
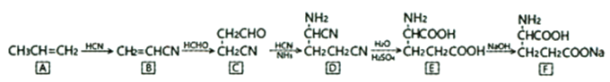
回答下列问题:
(1)E(谷氨酸)中的官能团名称是________。
(2)B→C的反应类型为________。
(3)A→F六种有机物中,含有手性碳原子的是________。
(4)D→E的化学方程式为________。
(5)有人造羊毛之称的腈纶纤维是B的加聚产物,该聚合物结构简式为________。
(6)写出一种核磁共振氢谱只有三组峰,且面积比为6:2:1的E同分异构体的结构简式________。
(7)参考丙烯合成谷氨酸钠方案设计苯乙烯(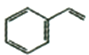 )为原料制备苯丙氨酸(
)为原料制备苯丙氨酸(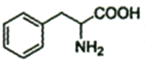 )的合成路线(无机试剂任选)__。
)的合成路线(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与图所示一致的是( )
A.图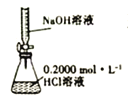 用于测定NaOH溶液的浓度
用于测定NaOH溶液的浓度
B.图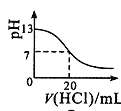 表示25
表示25![]() 时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
时,用0.1mol·L-1盐酸滴定20mL0.1mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
C.图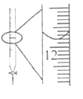 记录滴定终点读数为12.00 mL
记录滴定终点读数为12.00 mL
D.电导率是衡量电解质溶液导电能力大小的物理量,图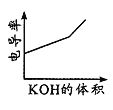 表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
表示KOH溶液滴定CH3COOH溶液时溶液的电导率变化曲线示意图
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R的原子序数依次增大,X是宇宙中含量最多的元素,Y原子最外层电子数等于内层电子数的2倍。向100 mL X2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如图。下列说法正确的是( )
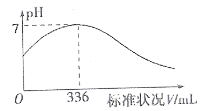
A.X2R溶液的浓度为0.03 molL1
B.最简单气态氢化物的稳定性:Y>Z>R
C.X、Y、Z三种元素形成的化合物一定易溶于水
D. RZ2分别通入到X2R、Ba(NO3)2溶液中,均会产生沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl难溶于水,广泛应用于电镀、印染等行业。工业上用辉铜矿(CuS2)为原料制取CuCl的一种流程图如下:

⑴写出“氧化Ⅰ”反应的离子方程式:______。
⑵写出“氧化Ⅱ”反应的离子方程式:_____。
⑶写出“还原”反应的离子方程式:______。
⑷将Cl2通入热的NaOH溶液,可以制得含NaClO3的溶液,写出该反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 、
、![]() 、
、![]() 、
、![]() 原子序数依次增大,
原子序数依次增大,![]() 与
与![]() 同主族但最高化合价不同,
同主族但最高化合价不同,![]() 是金属性最强的短周期元素。下列说法不正确的是( )。
是金属性最强的短周期元素。下列说法不正确的是( )。
A.简单离子半径:![]()
B.最高价氧化物对应水化物的酸性:![]()
C.化合物![]() 能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
能与水剧烈反应,产生白雾并放出具有刺激性气味的气体
D.![]() 的气态氢化物通入
的气态氢化物通入![]() 水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
水溶液中产生淡黄色沉淀并放出有刺激性气味的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com