
【题目】请依据化学知识回答下列问题:
(1)实验测得0.16g CH4完全燃烧生成224mLCO2(标准状况)和0.36g液态水,并放出8.903kJ的热量。则CH4的燃烧热为________kJmol-1。
(2)碳酸锰热解制二氧化锰分两步进行:
i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1
MnO(s)+CO2(g) H1=+a kJmol-1
ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1
2MnO2(s) H2=+b kJmol-1
请写出焙烧MnCO3制取MnO2的热化学方程式:______________________________________。
(3)下面是某同学探究可逆反应2NO2(g)![]() N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。
N2O4(g) H=-56.9 kJmol-1的部分实验报告,据此回答问题。

甲烧杯中NO2球的红棕色变浅。说明平衡2NO2(g)![]() N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
N2O4(g)向________(填“正反应”或“逆反应”)方向移动,所以NH4NO3晶体溶于水是________(填“放热”或“吸热”)过程。
(4)25°C时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请依此判断CH3COOH、H2CO3、HClO的酸性由强到弱的顺序是________________________
【答案】890.3 2MnCO3(s)+ O2(g)![]() 2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1 正反应 吸热 CH3COOH>H2CO3>HClO
2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1 正反应 吸热 CH3COOH>H2CO3>HClO
【解析】
(1)根据燃烧热为1mol可燃物完全燃烧生成稳定的氧化物时放出的热量。
(2)根据盖斯定律分析,反应热取决于反应物和生成物。
(3)根据温度对反应平衡的影响进行分析。
(4)根据电离平衡常数越大,酸性越强分析。
(1)0.16g CH4完全燃烧放出8.903kJ的热量,即0.01mol甲烷完全燃烧放出的热量,则甲烷的燃烧热为890.3kJ/mol。
(2)根据盖斯定律分析,i.MnCO3(s)![]() MnO(s)+CO2(g) H1=+a kJmol-1;ii.2MnO (s)+ O2(g)
MnO(s)+CO2(g) H1=+a kJmol-1;ii.2MnO (s)+ O2(g)![]() 2MnO2(s) H2=+b kJmol-1,有i×2+ ii得热化学方程式为:2MnCO3(s)+ O2(g)
2MnO2(s) H2=+b kJmol-1,有i×2+ ii得热化学方程式为:2MnCO3(s)+ O2(g)![]() 2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1。
2MnO2(s) +CO2(g) H=+(2a+b) kJmol-1。
(3)甲烧杯中NO2球的红棕色变浅,说明平衡向正反应方向进行,因为该反应为放热反应,说明NH4NO3晶体溶于水为吸热过程。
(4)根据电离平衡常数越大,说明其酸性越强分析,酸性强弱顺序为:CH3COOH>H2CO3>HClO。


科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3达到化学平衡状态,下列说法一定正确的是( )
2NH3达到化学平衡状态,下列说法一定正确的是( )
A.每1 mol N≡N断裂的同时有2 mol N—H生成
B.N2、H2、NH3的浓度之比为1∶3∶2
C.N2减少的速率和NH3减少的速率之比为1∶2
D.气体体积为初始体积的0.7倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知M(g)+N(g) ![]() P(g)+Q(g)反应的平衡常数和温度的关系如下:
P(g)+Q(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答:
(1)该反应的平衡常数表达式K=_____________ ,△H_____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的M和0.80mol的N,若反应6s内M的平均反应速率v(M)=0.003 mol·L-1·s-1。,则6s时c(M)=______ mol·L-1, P的物质的量为_______mol;若反应经一段时间后,达到平衡时N的转化率为______。
(3)判断该反应是否达到平衡的依据为_______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(M)不随时问改变 d.单位时间里生成P和Q的物质的量相等
(4)1200℃时反应P(g)+Q(g) ![]() M(g)+N(g)的平衡常数的值为______________。
M(g)+N(g)的平衡常数的值为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH![]() CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
A.该星球表面温度很高B.该星球表面温度很低
C.该反应为放热反应D.高温下稳定性CH2=CHOH>CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是
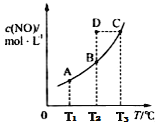
A. 该反应正反应的△H<0
B. 若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B)
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小![]() 对环境的影响,在倡导“低碳”的同时,还需加强对
对环境的影响,在倡导“低碳”的同时,还需加强对![]() 创新利用的研究.
创新利用的研究.![]() 时,将
时,将![]() 和
和![]() 充入3L密闭容器中,发生反应
充入3L密闭容器中,发生反应![]() ,
,![]() ,容器中
,容器中![]() 的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为
的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为![]() ,改变某一条件重新进行上述反应,
,改变某一条件重新进行上述反应,![]() 的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
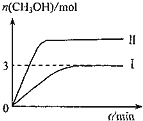
A.曲线Ⅱ对应的条件改变是增大压强
B.![]() 时,上述反应平衡常数为
时,上述反应平衡常数为![]() ,则
,则![]()
C.在![]() ,若起始时向容器中充入5mol
,若起始时向容器中充入5mol![]() 、5mol
、5mol![]() 、5mol
、5mol![]() 和5mol
和5mol![]() ,则达平衡前
,则达平衡前![]() 正
正![]() 逆
逆![]()
D.在![]() ,若起始时向容器由充入
,若起始时向容器由充入![]() 、6mol
、6mol![]() ,平衡时容器内压强
,平衡时容器内压强![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向容积为 ![]() 的密闭容器中充入
的密闭容器中充入 ![]() 和
和 ![]() ,发生如下反应:
,发生如下反应:![]() ,
,![]() 后反应达到平衡时
后反应达到平衡时![]() 为
为 ![]() 。
。![]() 的平衡物质的量浓度
的平衡物质的量浓度![]() 与温度关系如图所示。下列说法错误的是
与温度关系如图所示。下列说法错误的是![]()

A.![]() ,
,![]() 的平均反应速率为
的平均反应速率为 ![]()
B.反应![]() 的
的![]()
C.在![]() 时,若反应处于状态D,则一定有
时,若反应处于状态D,则一定有![]()
D.若![]() 、
、![]() 时的平衡常数分别为
时的平衡常数分别为![]() 、
、![]() ,则
,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对KSCN的性质进行探究,设计如下实验:
试管中试剂 | 实验 | 滴加试剂 | 现象 |
KSCN溶液 | Ⅰ | i.先加1 mL 0.1 mol/L FeSO4溶液 ii.再加硫酸酸化的KMnO4溶液 | i.无明显现象 ii.先变红,后退色 |
Ⅱ | iii.先滴加1 mL 0.05 mol/L Fe2(SO4)3溶液 iv.再滴加0.5 mL 0.5 mol/L FeSO4溶液 | iii.溶液变红 iv.红色明显变浅 |
(1)①用离子方程式表示实验I溶液变红的原因___________
②针对实验I中红色褪去的原因,小组同学认为是SCN被酸性KMnO4氧化为SO42,并设计如图实验装置证实了猜想是成立的。
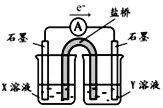
其中X溶液是_____________,检验产物SO42的操作及现象是__________。
(2)针对实验Ⅱ“红色明显变浅”,实验小组提出预测。
原因①:当加入强电解质后,增大了离子间相互作用,离子之间牵制作用增强,即“盐效应”。“盐效应”使Fe3++SCN![]() [Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
[Fe(SCN)]2+平衡体系中的Fe3+跟SCN结合成[Fe(SCN)]2+的机会减少,溶液红色变浅。
原因②:SCN可以与Fe2+反应生成无色络合离子,进一步使Fe3++SCN![]() [Fe(SCN)]2+平衡左移,红色明显变浅。
[Fe(SCN)]2+平衡左移,红色明显变浅。
已知:Mg2+与SCN难络合,于是小组设计了如下实验:
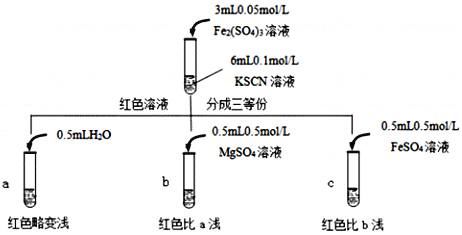
由此推测,实验Ⅱ“红色明显变浅”的原因是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com