
【题目】现代化城市建设离不开各种材料。
(1)水泥具有________性和强吸水性;水泥砂浆是________、________和水的混合物,是建筑用黏合剂;混凝土是________、________和________的混合物,用钢筋做结构的混凝土强度很大。
(2)玻璃生产的主要原料是________、________和________。
【答案】水硬 水泥 沙子 水泥 沙子 碎石 碳酸钠 碳酸钙 二氧化硅
【解析】
水泥是硅酸二钙、硅酸三钙和铝酸三钙的混合物,它遇水容易硬化。为增大其强度,常掺入沙子、碎石、钢筋等,构成各种混凝土,以满足生产、生活的需要。
玻璃是硅酸钠、硅酸钙、二氧化硅的混合物,能够抗酸碱的腐蚀。
(1)水泥遇水会发生硬化,所以具有水硬性和强吸水性;往水泥中掺入沙子和水,便成为水泥砂浆,水泥砂浆是水泥、沙子和水的混合物,是建筑用黏合剂;水泥砂浆中再掺入石子,就成为混凝土,混凝土是水泥、沙子和碎石的混合物,用钢筋做结构的混凝土强度很大。答案为:水硬;水泥;沙子;水泥;沙子;碎石;
(2)生产普通硅酸盐玻璃时,发生两个反应:SiO2+Na2CO3![]() Na2SiO3+CO2↑、SiO2+CaCO3
Na2SiO3+CO2↑、SiO2+CaCO3![]() CaSiO3+CO2↑,所以玻璃生产的主要原料是碳酸钠、碳酸钙和二氧化硅。答案为:碳酸钠;碳酸钙;二氧化硅。
CaSiO3+CO2↑,所以玻璃生产的主要原料是碳酸钠、碳酸钙和二氧化硅。答案为:碳酸钠;碳酸钙;二氧化硅。


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】在不同条件下分别测得反应2SO2+O2![]() 2SO3的化学反应速率,其中表示该反应进行得最快的是( )
2SO3的化学反应速率,其中表示该反应进行得最快的是( )
A.v(SO2)=4mol/(L·min)B.v(O2)=3mol/(L·min)
C.v(SO2)=0.1mol/(L·s)D.v(O2)=0.1mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各实验中所选用的实验仪器不能都用到的是
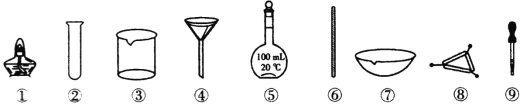
A.除去Na2CO3溶液中的CaCO3,选用③、④和⑥
B.NaC1溶液的蒸发结晶,选用①、⑥和⑦
C.配制100mL 0.1mol·L-1的NaOH溶液,选用③、⑤、⑥和⑨
D.将海带灼烧灰化,选用①、⑦和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=_________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为________________________________________。
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线_____(填“a”或“b”)对应脱氢法,判断依据是_____________________________________。
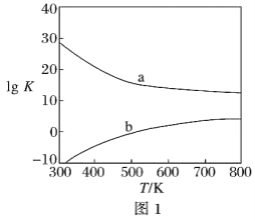
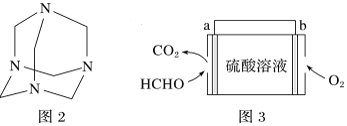
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为___________。
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则a极的电极反应式为_________________________________________________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为________________mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。

I.利用装置A和C制备Sr3N2
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先将___________,然后稍稍用力即可将玻璃管插入橡皮管。
(2)写出由装置A制备N2的化学反应方程式___________。
(3)装置A中a导管的作用是________。利用该套装置时,有同学提出应先点燃置A的酒精灯一段时间后,再点燃装置C的酒精灯,你同意其观点吗?_______(“同意”或“不同意”)。理由是___________。
Ⅱ.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(4)写出装置B的NaOH溶液中发生反应的离子方程式___________。
(5)装置C中广口瓶盛放的试剂是___________。
Ⅲ.测定Sr3N2产品的纯度
(6)取10.0g该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是_______。经改进后测得浓硫酸增重1.02g,则产品的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2000年诺贝尔化学奖授予两位美国化学家和一位日本化学家,以表彰他们在导电塑料领域的贡献,他们首先把聚乙炔树脂制成导电塑料,下列关于聚乙炔的叙述错误的是( )
A. 聚乙炔是以乙炔为单体发生加聚反应形成的高聚物
B. 聚乙炔的化学式为![]()
C. 聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质
D. 聚乙炔树脂不加任何填充物即可成为电的良导体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
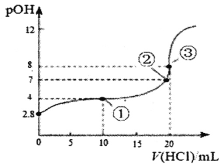
A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(如图1),一段时间后换成蒸馏装置(如图2)进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品,请回答下列问题:
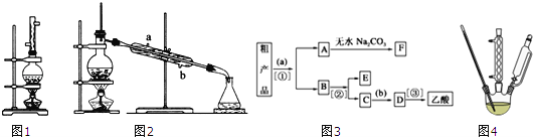
(1)在图1烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入__,目的是__,冷凝管的作用是__;
(2)图2中冷凝水应从__口进;
(3)现设计分离以上粗产品的操作步骤如图3,已知a为饱和碳酸钠溶液,①为分液,请回答:试剂b是__;分离方法③是__;
(4)某化学课外小组设计了图4所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,主要优点有(写一点):__;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②加压___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com