
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2 。
(1)能判断该反应达到平衡状态的依据是__________(双选,填序号)。
A.容器内压强不变了 B.c(CO)不变了
C.v正(CO2)=v逆(CO) D.c(CO2)=c(CO)
(2)该反应的正反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。
①升高温度__________;②加压___________。
【答案】BC 吸热 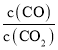 1.0 减小 不变
1.0 减小 不变
【解析】
(1)可逆反应到达平衡时,同种物质的正逆速率相等且保持不变,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不再变化说明到达平衡;
(2)温度升高平衡常数增大,升高温度平衡正向移动,正反应为吸热反应;
(3)化学平衡常数:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
CO2的起始浓度为2.0mol·L-1,某温度时达到平衡,此时容器中CO的浓度1.0mol·L-1,则平衡时CO2的浓度为1.0mol·L-1,代入平衡常数表达式计算;
(4)①正反应为吸热反应,升高温度平衡正向移动,二氧化碳物质的量减小,混合气体总物质的量不变,二氧化碳的物质的量分数减小;
②加压,平衡向气体体积减小的方向移动。
(1)A.混合气体物质的量不变,恒温恒容下,容器内压强为定值,故A错误;
B. c(CO)保持不变,说明正逆反应速率相等,反应到达平衡,故B正确;
C.v正(CO2)=v逆(CO)时,CO的消耗速率与生成速率相等,反应达到了平衡状态,故C正确;
D.平衡时CO2、CO浓度与二氧化碳的转化率有关,不一定相等,故D错误,
故选:BC;
(2)温度升高平衡常数增大,升高温度平衡正向移动,正反应为吸热反应,
故答案为:吸热;
(3)Fe(s)+CO2(g)![]() FeO(s)+CO(g)化学平衡常数表达式K=
FeO(s)+CO(g)化学平衡常数表达式K=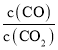 ,CO2的起始浓度为2.0mol·L-1,某温度时达到平衡,此时容器中CO的浓度1.0mol·L-1,则平衡时CO2的浓度为1.0mol·L-1,则该温度下平衡常数K=
,CO2的起始浓度为2.0mol·L-1,某温度时达到平衡,此时容器中CO的浓度1.0mol·L-1,则平衡时CO2的浓度为1.0mol·L-1,则该温度下平衡常数K=![]() =1.0,
=1.0,
故答案为: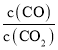 ;1.0;
;1.0;
(4)①正反应为吸热反应,升高温度平衡正向移动,二氧化碳物质的量减小,混合气体总物质的量不变,二氧化碳的物质的量分数减小;
②反应是气体体积不变的反应,混合气体总物质的量不变,二氧化碳的物质的量分数不变;
故答案为:减小;不变.


科目:高中化学 来源: 题型:
【题目】现代化城市建设离不开各种材料。
(1)水泥具有________性和强吸水性;水泥砂浆是________、________和水的混合物,是建筑用黏合剂;混凝土是________、________和________的混合物,用钢筋做结构的混凝土强度很大。
(2)玻璃生产的主要原料是________、________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是( )
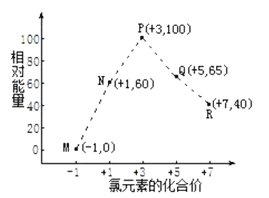
A.P点对应的微粒最稳定
B.R点微粒氧化性最强
C.由N点到M点的焓变为60kJ·mol-1
D.P点微粒发生歧化反应转化为N点和Q点微粒属于自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
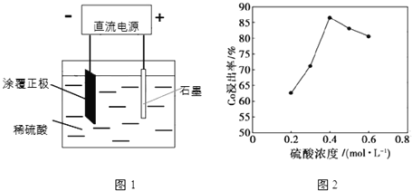
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式 (i)I2(g)+H2(g)![]() 2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)
2HI(g) △H=" -" 9.48kJ/mol ,(ii) I2(s)+H2(g)![]() 2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
2HI(g) △H=" +" 26.48kJ/mol,下列判断正确的是
A. 254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1mol气态碘所含的能量相差l7.00 kJ
C. 反应(i)的产物比反应(ii)的产物稳定
D. 反应(i) 拆开1mol I-I键与1mol H-H键需要的总能量小于拆开2mol H-I键需要的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2和H2的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000 mol·L1 NaOH溶液滴定20.00 mL 0.1000 mol·L1的H3A溶液的滴定曲线如图所示。己知H3A的pKa1、pKa2、pKa3分别为2、7和12(pKa=-lgKa),下列说法正确的是
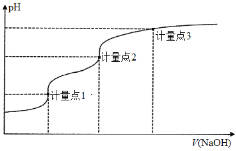
A.滴定前溶液pH值约为3
B.计量点1时,可以用甲基橙作为指示剂
C.到达计量点2时,溶液中存在c(Na+)=c(H2A-)+2c(HA2-)+3c(A3-)
D.到达计量点3时,微热溶液,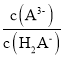 会增大
会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH ![]() CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
CH3CHO+H2↑。CH3CH2OH的沸点高于CH3CHO的主要原因是________;从原子轨道重叠方式分类,H2分子中σ键类型是____________。
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(![]() )为___________ (用π含的式子表示),(提示原子空间利用率=
)为___________ (用π含的式子表示),(提示原子空间利用率=![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com