
����ֻ�ܱ�����A��B��A������һ�����ƶ�����ʹ�����ڱ��ֺ�ѹ��B�������ֺ��ݣ���ʼʱ����ֻ�����зֱ��������������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ��ڱ���400��������ʹ֮������Ӧ��2SO2+O2⇌2SO3 ��д���пհף�
��1���ﵽƽ������ʱ��A��B���̡���A��SO2��ת���ʱ�B����
��2���ﵽ��1������ƽ�������������ͨ����������ĵ��������A�����Ļ�ѧƽ���ƶ���B�����Ļ�ѧƽ�⡡�����ƶ���
��3���ﵽ��1������ƽ�������������ͨ�������ԭ��Ӧ���壬�ﵽƽ���A��SO3��������������䡡������С�����䣩��B������SO3���������������
| ��ѧƽ���Ӱ�����أ�. | |
| ר�⣺ | ��ѧƽ��ר�⣮ |
| ������ | ��1�����ݻ�ѧ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣����õ�Чƽ�����ж�ƽ���ƶ������ ��2�����������е�ѹǿ�Ի�ѧƽ���Ӱ�죻 ��3������Ũ�ȶԻ�ѧƽ���Ӱ�죬���ƽ���ƶ���SO3��������� |
| ��� | �⣺��1����A�������ֺ�ѹ����Ӧ�����������С��Ũ��������Ũ��Խ��ѧ��Ӧ����Խ�죬����ƽ���ʱ��Խ�̣����Դﵽƽ������ʱ��A��B�̣���A�������ֺ��ݣ�������������ƽ���Ч����ʵ����A����������٣�ѹǿ����ƽ��������Ӧ�����ƶ�������A��SO2��ת���ʱ�B�ʴ�Ϊ���̣��� ��2��ƽ�������������ͨ����������ĵ��������A�����������ѹǿ���䣬�μӷ�Ӧ�����������ѹǿ���٣�ƽ�����淴Ӧ�����ƶ���A����������䣬ѹǿ���μӷ�Ӧ�����������ѹǿ���䣬ƽ�ⲻ�ƶ����ʴ�Ϊ������ ��3������������ͨ�������ԭ��Ӧ���壬�ﵽƽ���A�н�����ƽ����ԭƽ���Ч������SO3������������䣬B�����н�����ƽ���൱����ԭƽ��Ļ���������ѹǿ��ƽ�������ƶ���B������SO3������������ʴ�Ϊ�����䣻���� |
| ������ | ���⿼�黯ѧƽ���ƶ����жϣ������ѶȽϴ�ע���Чƽ��������Ӧ�ã� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ����
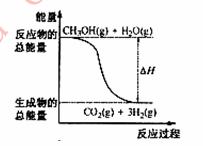
��CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ��H= + 49.0 kJ/mol
��CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ��H=��192.9 kJ/mol
����˵����ȷ���ǣ� ��
A��CH3OH��ȼ����Ϊ192.9 kJ/mol
B����Ӧ���е������仯����ͼ��ʾ
C��CH3OHת���H2�Ĺ���һ��Ҫ��������
D�����ݢ���֪��CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) ��H > ��192.9kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������������μ���������Һ���Ȳ�������������ܽ����( )
A��ϡ���ᡡ��B���ƾ��� ��C��������������Һ�� ��D���Ȼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���淴ӦA+B��s��⇌C�ﵽƽ������ۼ�ѹ���£�B��ת���ʶ����������н�����ȷ���ǣ�������
| �� | A�� | AΪ���壬CΪ���壬����ӦΪ���ȷ�Ӧ |
| �� | B�� | A��C��Ϊ���壬����ӦΪ���ȷ�Ӧ |
| �� | C�� | AΪ���壬CΪ���壬����ӦΪ���ȷ�Ӧ |
| �� | D�� | AΪ���壬CΪ���壬����ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX��g��+Y��g��⇌2Z��g����H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±�������˵����ȷ���ǣ�������
| t/min | 2 | 4 | 7 | 9 |
| n��Y��/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| �� | A�� | ��Ӧǰ2min��ƽ������v��Z��=2.0��10��3mol/��L•min�� |
| �� | B�� | �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv���棩��v������ |
| �� | C�� | ���¶��´˷�Ӧ��ƽ�ⳣ��K=144 |
| �� | D�� | �����������䣬�ٳ���0.2mol Z��ƽ��ʱX������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з������ݺͽ��۶���ȷ����
A��HClO��Ũ���ᡢHNO3�����������ԣ�������������
B��H2O��HCOOH��Cu2(OH)2CO3��������Ԫ�أ�����������
C��HF��CH3COOH��CH3CH2OH��������ˮ�����ǵ����
D��HCOOH��H2CO3��H2SO4�����о�����������ԭ�ӣ����Ƕ�Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪�����ε��ܽ��(S)��������ͼ��ʾ������˵������ȷ����
A����NaCl��Һ���ɿɵ�NaCl����
B����MgCl2��Һ���ɿɵ�MgCl2����
C������MgCl2��NaClO3�Ʊ�Mg(ClO3)2
D��Mg(ClO3)2�л�������NaCl���ʣ������ؽᾧ���ᴿ
 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬѧ����Fe2+��ԭ�Ե�ʵ�飬����쳣�������̽����
����һ����ȡFeCl2��Һ����0.1 mol•L-1 FeCl3��Һ�м��������������ú�ȡ�ϲ���Һ�����pH<1��
���������2 mL FeCl2��Һ�еμ�2��0.1 mol•L-1 KSCN��Һ���������ٵμ�5��5% H2O2��Һ�����ʵ���Ũ��ԼΪ1.5 mol•L-1��pHԼΪ5�����۲쵽��Һ��죬��Լ10�����Һ�ɫ��ȥ�����������ɣ�������ΪO2����
��1�������ӷ���ʽ��ʾ���������Һ����ԭ�� �� ��
��2����̽�����������Һ��ɫ��ԭ��
I. ȡ��ɫ����Һ���ݣ�һ�ݵμ�FeCl3��Һ��������һ�ݵμ�KSCN��Һ���ֺ�ɫ��
II.ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ������
III. ��2 mL 0.1 mol•L-1 FeCl3��Һ�еμ�2��0.1 mol•L-1 KSCN��Һ����죬ͨ��O2�������Ա仯��
�� ʵ��I��˵�� ��
�� ʵ��III��Ŀ���� ��
�ó����ۣ���Һ��ɫ��ԭ��������������H2O2��SCN-������SO42-��
��3����ֱ����FeCl2��4H2O���� mol•L-1 ��FeCl2��Һ���ظ�������еIJ���������Һ���ɫ��δ��ȥ����һ��̽����ԭ��
I���ü���ʷֱ������ɫҺ��͵μ���KSCN��Һ��FeCl3��Һ��ǰ���ж����ЧӦ�������ޡ�������FeCl2��Һ��pHԼΪ3���ɴˣ�����Ϊ��ɫ����ȥ�Ŀ���ԭ���� ��
II���������Ϻ��Ʋ⣬��ɫ����ȥ��ԭ������pH�ϴ�ʱH2O2��������SCN-�����������������Լ���ͨ��ʵ���ų�����һ���ܡ��ҵ�ʵ������������ǣ�
| ���� | �Լ������� | �� �� |
| i |
| ���ɰ�ɫ���� |
| ii | ��i������Һ�еμ�0.1 mol•L-1 FeCl3��Һ |
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£�������������Һ��
| �� | �� | �� | �� |
| 0.1mol/L NaOH��Һ | pH=11 NaOH��Һ | 0.1mol/L CH3COOH��Һ | pH=3 CH3COOH��Һ |
����˵����ȷ���� (����)
A����ˮ�������c(H+)����<��
B����ϡ�͵�ԭ����100����pH�����ͬ
C������ۻ�ϣ�����ҺpH=7����V(NaOH)>V(CH3COOH)
D������ܻ�ϣ�����Һ�����ԣ���������Һ������Ũ�ȿ���Ϊ��c(CH3COO��)> c(H+)
> c(Na+)>c(OH��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com