
【题目】以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。流程如图所示
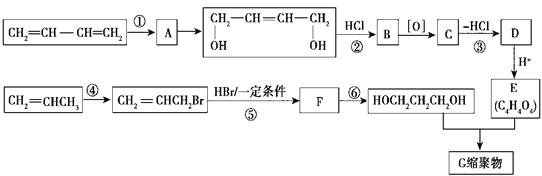
请完成下列各题:
(1)反应①发生的反应类型是 _________________。
(2)反应③发生的反应条件是 __________________。
(3)反应②、③的目的是 ________________________________________。
(4)写出反应⑤的化学方程式 ____________________________________________。
(5) B被氧化成C的过程中会有中间产物生成,该中间产物可能是 __________________(写出一种物质的结构简式),检验该物质存在的试剂是 _________________________。
【答案】 加成反应 NaOH/醇溶液(或KOH/醇溶液)、加热 防止双键被氧化 CH2=CHCH2Br+HBr![]() CH2Br-CH2-CH2Br
CH2Br-CH2-CH2Br ![]() (或
(或![]() 或
或![]() ,合理即可) 新制氢氧化铜悬浊液或银氨溶液
,合理即可) 新制氢氧化铜悬浊液或银氨溶液
【解析】流程分析:CH2=CH-CH=CH2与Cl2发生1,4-加成,生成A:ClCH2CH=CHCH2Cl;A在NaOH水溶液、加热条件下发生水解反应,生成HOCH2CH=CHCH2OH;反应②为HOCH2CH=CHCH2OH与HCl发生加成反应,生成B:HOCH2CH2CHClCH2OH;B氧化得到C,C消去HCl得到D,D酸化得到E:C4H4O4,则D为盐;E与HOCH2CH2CH2OH发生缩聚反应,则E中含有两个-COOH,可推测E为HOOC-CH=CH-COOH;逆推,D为NaOOC-CH=CH-COONa;C为HOOC-CH2CHCl-COOH。CH3CH=CH2与溴发生取代反应生成BrCH2CH=CH2;BrCH2CH=CH2与HBr发生加成反应生成F:BrCH2CH2CH2Br,F在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH;HOCH2CH2CH2OH与HOOC-CH=CH-COOH进行缩聚反应生成G。
(1)反应①是CH2=CH-CH=CH2与Cl2发生1,4-加成反应。故答案为:加成反应;
(2)反应③是HOOCCH2CHClCOOH在氢氧化钠醇溶液(或KOH醇溶液)、加热条件下发生消去反应生成NaOOC-CH=CH-COONa;故答案为:氢氧化钠醇溶液(或KOH/醇溶液)、加热;
(3)HOCH2CH=CHCH2OH中含有碳碳双键,氧化羟基时也可以氧化碳碳双键,转化生成E为HOOCCH=CHCOOH,E中含有C=C双键,故反应②③的目的是:保护碳碳双键,防止被氧化。故答案为:保护碳碳双键,防止被氧化;
(4)反应⑤为BrCH2CH=CH2与HBr发生加成反应生成F:BrCH2CH2CH2Br,反应方程式为:CH2=CHCH2Br+HBr![]() CH2Br-CH2-CH2Br ;
CH2Br-CH2-CH2Br ;
(5)B(HOCH2CH2CHClCH2OH)在被氧化成C(HOOC-CH2CHCl-COOH)的过程中,可能氧化不完全,会有中间产物生成,该中间产物可能是HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH。中间产物中含有醛基,可以用新制氢氧化铜悬浊液或银氨溶液进行检验。
故答案为:HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH;新制氢氧化铜悬浊液或银氨溶液。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】S2Cl2用作橡胶的低温硫化剂和粘结剂,由硫与限量氯气在50~60℃反应制得,进一步氯化可得SCl2、S2Cl2、SCl2的某些性质如下:
水溶性 | 密度(g/cm3) | 颜色 | 熔点 | 沸点 | |
S2Cl2 | 空气中发烟雾,通水即分解 | 1.687 | 金黄色 | -76℃ | 138℃ |
SCl2 | 溶于水且剧烈反应 | 1.621 | 樱桃红 | -122℃ | 59℃ |
用如图所示装置制备S2Cl2回答下列问题:
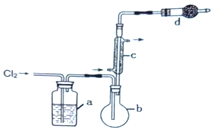
(1)写出S2Cl2的电子式_________。
(2)写出仪器c的名称_________;实验开始前先在b中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一固体薄层,这样做的目的是_________。
(3)实验时,b装置需加热。最好采用何种方式加热_________。
(4)b中的反应开始前,需排除装置中的空气,简述相关操作:_________。
(5)装置d中盛放的试剂是_________;其作用是①_________②_________。
(6)为了获得更纯净的S2Cl2,需要对产品进行的操作是_________。
(7)若将S2Cl2放入水中同时产生沉淀和气体,写出反应的方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.HCl属于共价化合物,溶于水能电离出H+和Clˉ
B.NaOH是离子化合物,该物质中只含有离子键
C.HI气体受热分解的过程中,只需克服分子间作用力
D.石英和干冰均由原子构成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
A | NH3(H2O) | 浓硫酸 | 洗气 |
B | KCl固体(I2) | KOH溶液 | 加热 |
C | H2O(Br2) | CCl4 | 分液 |
D | Cl2(HCl) | KOH溶液 | 洗气 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。对于组成为CaOCl2的盐可归类于( )
A. 混盐 B. 复盐 C. 络盐 D. 无法归属于上述类别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离常数(Ka或Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的计算或运用正确的是( )
A. 某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×10-8.60
B. Ka(HCN)<Ka(CH3COOH),说明同浓度时氢氰酸的酸性比醋酸强
C. Ksp(AgI)<Ksp(AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀
D. Ksp(AgCl)<Ksp(AgOH),说明AgOH和AgCl均不溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
请完成以下实验设计表,并在实验目的一栏中填空:
实验 编号 | 温度 (℃) | 大理石 规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (I)实验①和②探究浓度对反应速率的影响; (II)实验①和③探究温度对反应速率的影响; (III)实验①和④探究______________对反应速率的影响 |
② | 25 | 粗颗粒 | _______ | |
③ | _____ | 粗颗粒 | 2.00 | |
④ | 25 | 细颗粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密闭容器里,发生反应:3A(g)+B(g)![]() xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
xC(g)+2D(g),经5 s后反应达平衡。在此5 s内C的平均反应速率为0.2 mol/(L·s),同时生成1 mol D。试求:
(1)达平衡时B的转化率为_____________________。
(2)x的值为___________________。
(3)若温度不变,达平衡时容器内气体的压强是反应前的____________倍。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com