
【题目】利用平衡移动原理能证明Na2SO3溶液中存在下列平衡SO32-+H2O![]() HSO3-+OH-事实的是
HSO3-+OH-事实的是
A. 滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B. 滴入酚酞溶液变红,再加入氯水后红色褪去
C. 滴入酚酞溶液变红,再加入NaOH溶液后红色加深
D. 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】室温下,下列事实不能说明NH3H2O为弱电解质的是
A. 0.1 molL-1 NH3H2O溶液的pH小于13
B. Al(OH)3在浓氨水中不能溶解
C. 相同条件下,浓度均为0.1 molL-1的NaOH溶液和氨水,氨水的导电能力弱
D. 向0.1 molL-1 NH3H2O溶液中加入MgCl2溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车发动机工作时会产生包括CO、NOx等多种污染气体,涉及到如下反应:
①N2(g)+O2(g)![]() 2NO(g)
2NO(g)
②2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
③NO2(g)+CO(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
弄清上述反应的相关机理,对保护大气环境意义重大,回答下列问题:
(1)请根据下表数据填空:N2(g)+O2(g) ![]() 2NO(g) △H=________。
2NO(g) △H=________。
物质 | N2 | O2 | NO |
能量(kJ) | 946 | 497 | 811.25 |
(断开1mol物质中化学键所需要的能量)
(2)实验测得反应2NO(g)+O2(g)![]() 2NO2(g) △H<0的即时反应速率满足以下关系式:
2NO2(g) △H<0的即时反应速率满足以下关系式:
v正=k正·c2(NO)·c(O2);v逆=k逆·c2(NO2),k正、k逆为速率常数,受温度影响
①温度为T1时,在1L的恒容密闭容器中,投入0.6 molNO和0.3 molO2达到平衡时O2为0.2 mol;温度为T2时,该反应存在k正=k逆,则T1_______ T2 (填“大于”、“小于”或“等于”)。
②研究发现该反应按如下步骤进行:
第一步:NO+NO![]() N2O2 快速平衡 第二步:N2O2 +O2
N2O2 快速平衡 第二步:N2O2 +O2![]() 2NO2 慢反应
2NO2 慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v1正=k1正×c2(NO);v1逆=k1逆×c(N2O2)
下列叙述正确的是______
A.同一温度下,平衡时第一步反应的![]() 越大反应正向程度越大
越大反应正向程度越大
B.第二步反应速率低,因而转化率也低
C.第二步的活化能比第一步的活化能低
D.整个反应的速率由第二步反应速率决定
(3)科学家研究出了一种高效催化剂,可以将CO和NO2两者转化为无污染气体,反应方程式为:2NO2(g)+4CO(g) =4CO2(g)+N2(g) △H<0
某温度下,向10L密闭容器中分别充入0.1molNO2和0.2 molCO,发生上述反应,随着反应的进行,容器内的压强变化如下表所示:
时间/min | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
压强/kPa | 75 | 73.4 | 71.95 | 70.7 | 69.7 | 68.75 | 68.75 |
回答下列问题:
①在此温度下,反应的平衡常数Kp=_________kPa-1(Kp为以分压表示的平衡常数,计算结果精确到小数点后2位);若保持温度不变,再将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”);
②若将温度降低,再次平衡后,与原平衡相比体系压强(p总)如何变化?_______(填“增大”、“减小”或“不变”),原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月9 日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如![]() 、
、![]() 等。下列说法正确的是( )
等。下列说法正确的是( )
A.![]() 和
和![]() 的化学性质不同
的化学性质不同
B.Ts位于周期表的第六周期ⅦA族
C.元素Ts的相对原子质量为293.5
D.![]() 和
和![]() 质子数相同,中子数不同
质子数相同,中子数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 235g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +10
+10![]() 净产生的中子(
净产生的中子(![]() )数为10NA
)数为10NA
B. 常温下,0.5L pH=14的Ba(OH)2溶液中OH-数目为NA
C. 一定条件下,32gSO2与足量O2反应,转移的电子数为NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)![]() 4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是
4C(g)+D(g)ΔH<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如图。下列说法正确的是

A. 当温度升高后,则图中θ>45°
B. 若再加入B,再次达到平衡状态时,正、逆反应速率均增大
C. 平衡时B的转化率为50%
D. 若再加入B,则平衡后反应体系气体密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
2HI(g),温度为T时,在两个体积均为1 L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w (HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2、0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=ka·w(H2)·w(I2),v逆=kb·w2(HI),其中ka、kb为常数。下列说法正确的是:
A. 温度为T时,该反应![]()
B. 容器I中在前20 min的平均速率v(HI)=0.0125 mol·L-1·min-1
C. 若起始时向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行
D. 若两容器中存在kaⅠ= kaⅡ且kbⅠ= kbⅡ,则x的值可以为任何值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱除烟气中的氮氧化物(主要是指NO和NO2)可以净化空气、改善环境,是环境保护的主要课题。
(1)以漂粉精溶液为吸收剂脱除烟气中的NO,相关热化学方程式如下:
ⅰ.4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =﹣423 kJ·mol-1
ⅱ.Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =﹣120 kJ·mol-1
ⅲ.3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
① H3 = _______kJ·mol-1 。
② 反应ⅲ的平衡常数随温度升高的变化趋势是________。
(2)HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂粉精的化学方程式是________。
(3)次氯酸盐脱除NO的主要过程如下:
a.NO+HClO = NO2+HCl
b.NO + NO2+H2O 2HNO2
c.HClO+ HNO2 = HNO3+HCl
下列分析正确的是________。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
(4)研究不同pH、不同温度下漂粉精溶液对NO脱除率的影响,结果如图1、图2。
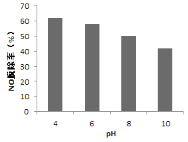

图1 图2
① 图1中,pH降低NO脱除率增大的原因:________。
② 脱除过程中往往有Cl2产生,原因是________(用离子方程式表示)。
③ 图2中,60~80℃ NO脱除率下降的原因:________。(至少答出两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①5.2g的气态乙炔(C2H2)在氧气中燃烧,生成二氧化碳和液态水,放出260kJ的热量,其热化学方程式为:___________________________________________________________。又知H2O(l)==H2O(g)△H= +44kJ/mol,则11.2L(标准状况)乙炔完全燃烧生成气态水时放出的热量是_________kJ。
②已知:CH4 的燃烧热为890 kJ/mol,H2的热值为142.5kJg-1,现有标准状况下22.4 L CH4和H2的混合气体完全燃烧时,放出的热量为527kJ,求混合气体中CH4 和H2的体积比_____________
③将1mol NO2投入到1L容器中进行 2NO2(g)![]() N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
N2O4(g)反应,达到平衡后将体积压缩到原来的一半再次达到平衡,则第一次平衡体系的颜色比第二次平衡的颜色_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com