
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) ![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=_______。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_____________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq) ![]() PbI2(s)+2Cl-(aq)的平衡常数K=_________。
PbI2(s)+2Cl-(aq)的平衡常数K=_________。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) =2HI(g) 的ΔH__________(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
【答案】-12kJ/mol 25% 小 随着Y值的增加,![]() 的体积分数
的体积分数![]() 减小,平衡CO(g)+2H2(g)
减小,平衡CO(g)+2H2(g)![]() CH3OH(g)逆向移动,故Y表示温度 2mol
CH3OH(g)逆向移动,故Y表示温度 2mol ![]() 4000 小于
4000 小于 ![]()
![]() 减小
减小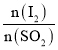 的投料比
的投料比
【解析】
(1)反应热![]() 反应物总键能
反应物总键能![]() 生成物总键能,故
生成物总键能,故![]() ,故答案为:
,故答案为:![]() ;
;
(2)①设CO的转化量是x mol,则
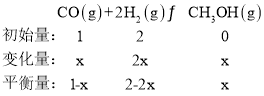
根据题意,平衡时,![]() 的体积分数为
的体积分数为![]() ,则
,则![]() ,
,![]() ,所以CO的转化率为
,所以CO的转化率为![]() ,故答案为:
,故答案为:![]() ;
;
②根据图示信息:X轴上a点的数值比b点小,随着Y值的增加,![]() 的体积分数
的体积分数![]() 减小,平衡逆向移动,故Y表示温度,故答案为:小;随着Y值的增加,
减小,平衡逆向移动,故Y表示温度,故答案为:小;随着Y值的增加,![]() 的体积分数
的体积分数![]() 减小,平衡逆向移动,故Y表示温度;
减小,平衡逆向移动,故Y表示温度;
(3)由四氧化三铅和氢碘酸反应制备难溶的![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() ,HI做还原剂,碘元素化合价
,HI做还原剂,碘元素化合价![]() 价变化为
价变化为![]() ,每生成3mol
,每生成3mol![]() 的反应中电子转移2mol,故答案为:2mol;
的反应中电子转移2mol,故答案为:2mol;
(4)![]() 饱和溶液
饱和溶液![]() 呈黄色
呈黄色![]() 中
中![]()
![]() ,沉淀溶解平衡
,沉淀溶解平衡![]() ,
,![]()
![]() ,
,![]() ,则
,则![]()
![]() ;反应
;反应![]() 的平衡常数
的平衡常数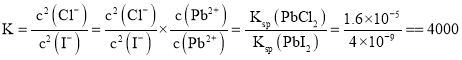 ,故答案为:
,故答案为:![]() ;4000;
;4000;
(5)①图象中分析可知随温度的升高,HI减小,![]() 增大,反应
增大,反应![]() 说明升温平衡逆向进行,正反应为放热反应,
说明升温平衡逆向进行,正反应为放热反应,![]() ,故答案为:小于;
,故答案为:小于;
②根据图知,b为从0逐渐增大的两种,a和c始终不变,且a、c的物质的量之比为3:1,根据![]() 、
、![]() ,反应中
,反应中![]() 越来越多,H+、HSO4-始终不变,且n(H+):n(HSO4-)=3:1,所以a为H+、b为I3-;由图2知,横坐标数值越大I3-越多、I-越少,要提高碘的还原率需要控制温度外,还需要减小
越来越多,H+、HSO4-始终不变,且n(H+):n(HSO4-)=3:1,所以a为H+、b为I3-;由图2知,横坐标数值越大I3-越多、I-越少,要提高碘的还原率需要控制温度外,还需要减小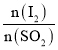 的投料比,故答案为:
的投料比,故答案为:![]() 、
、![]() ;减小
;减小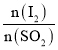 的投料比。
的投料比。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸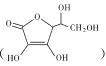 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A. ![]()
B. 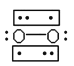
C. ![]()
D. 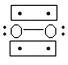
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+ 和Cu2+的装置如右图。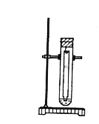
以下叙述错误的是
A.该方法为径向纸上层析法B.试样点晾干后才能补滴
C.试样点不能接触展开剂D.可喷KSCN溶液检验分离出来的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以肼(N2H4)为燃料的新型环保电池的工作原理如图所示。下列说法正确的是
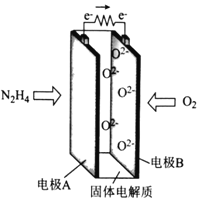
A. 电极A的电势比电极B的低
B. 电极A的电极反应式为N2H4-4e-+4OH-===N2+4H2O
C. 电极B发生氧化反应
D. 每消耗11.2L的O2,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用____润洗。
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面。如果液面初始位置如图所示,则此时的读数为____mL。
![]()
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察____(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
初读数 | 末读数 | 消耗体积 | ||
1 | 15.00 | 0.50 | 17.75 | ____ |
2 | 15.00 | 0.05 | 16.10 | 16.05 |
3 | 15.00 | 0.00 | 15.95 | 15.95 |
(4)请填写1组反应消耗的氢氧化钠溶液体积。
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是___mL。若NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为___mol/L。
(6)在本实验过程中,下列操作不会造成实验误差的是___(选填编号)。
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.电解饱和食盐水时,若生成11.2LCl2,则生成H2分子的数目为0.5NA
B.28g分子式为CnH2n的链烃中含有的共用电子对数目为6NA
C.1mol晶体硅中含有的共价键数目为4NA
D.87gMnO2与100mL12mol·L-1的浓盐酸共热,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的FuNvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂lmolNN吸收167kJ热量,生成1molN≡N放出945kJ热量。根据以上信息,下列说法正确的是( )
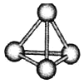
A.N4属于由非极性键构成的极性分子
B.氮元素非金属性比磷强,可知N4沸点比P4高
C.1molN4气体转变为N2气体放出888kJ热量
D.N4与N2互为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com