
| 实验 序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | 1.50 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.67 | 0.61 | 0.56 | 0.20 | 0.56 | 0.56 |
| △c |
| t |
| △c |
| t |
| 1.5-0.6 |
| 30 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 550 | 650 | 750 | 850 | 897 |
| 压强/Pa | 5.32×10 | 9.17×102 | 8.37×103 | 4.34×104 | 1.01×105 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯塑料不会造成环境污染 |
| B、煤经过气化和液化等物理变化可转化为清洁燃料 |
| C、通过蒸发可从海水中提取溴、碘、镁 |
| D、利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、动态平衡状态在自然界和工农业生产中很少见 |
| B、化学反应的速率和限度均可通过改变相应的化学反应条件而改变 |
| C、物质发生化学反应都伴随着能量变化 |
| D、化学反应达到平衡状态时,正反应速率与逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,降低温度,反应达到新平衡前v(逆)<v(正) |
| C、该温度下此反应的平衡常数K=144 |
| D、其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
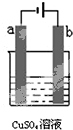 如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )
如图为直流电源电解1L 0.2mol/L的CuSO4水溶液的装置.通电一段时间后,b电极共收集到4.48L的气体(标准状况下),然后在石墨电极a和b附近分别滴加一滴石蕊试液,下列关于实验的叙述中不正确的是( )| A、a电极的产物有Cu和H2 |
| B、反应一段时间后,溶液的pH值变小 |
| C、a电极附近呈红色,b电极附近出现蓝色 |
| D、a、b电极转移的电子数为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2用作呼吸面具的供氧剂 |
| B、工业上电解熔融状态Al2O3制备Al |
| C、工业上利用合成氨实现人工固氮 |
| D、实验室制二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com