
【题目】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
Ⅰ.丙烷(C3H8)是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1molH2O(I)过程中的能量变化图。试回答下列问题:

(1)写出丙烷燃烧的热化学方程式:__________。
(2)二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ的热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ的热量,则混合气体中丙烷和二甲醚的物质的量之比为__________。
Ⅱ.用下图所示的装置进行中和热的测定实验,分别取50mL0.55mol/L的NaOH溶液、50mL0.25mol/L的硫酸进行实验,回答下列问题:
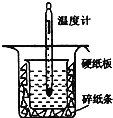
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是__________。
(2)近似认为0.55mol/L的NaOH溶液和0.25mol/L的硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃),通过以下数据计算中和热△H=__________(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等”或“不相等”)。 所求中和热___(填“等”或“不相等”),简述理由__________________________________________。
(4)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.将以上四实验测量温度均纳入计算平均值
【答案】C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol1∶3环形玻璃棒未将小烧杯和大烧杯杯口保持相平-56.8kJ/mol不相等相等中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关abc
【解析】
Ⅰ.(1)根据图象可知生成1mol液态水放出的热量是553.75kJ,则1mol丙烷完全燃烧生成4mol水放出的热量是![]() ,因此丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol;
,因此丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215.0kJ/mol;
(2)设混合气体中丙烷和二甲醚的物质的量分别是xmol、ymol,则x+y=1,1455y+2215x=1645kJ,解得x=0.25、y=0.75,因此混合气体中丙烷和二甲醚的物质的量之比为1:3;
Ⅱ.(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;为了减少热量的损失,大烧杯杯口与小烧杯杯口应该相平、小烧杯口用硬纸板盖住;
(2)第一次测定温度差为:(29.5-26.1)℃=3.4℃;第二测定温度差为:(32.3-27.2)℃=5.1℃;第三次测定温度差为:(29.2-25.9)℃=3.3℃;第四次测定温度差为:(29.8-26.3)℃=3.5℃;其中第二次的温度差误差较大,应该舍弃,其他三次温度差的平均值为:![]() 。50mL0.55mol/L的NaOH溶液与50mL0.25mol/L的硫酸进行中和反应,生成水的物质的量为0.05L
。50mL0.55mol/L的NaOH溶液与50mL0.25mol/L的硫酸进行中和反应,生成水的物质的量为0.05L![]() 0.50mol/L=0.025mol,溶液的质量为100mL
0.50mol/L=0.025mol,溶液的质量为100mL![]() 1g/mL=100g,温度变化的值为
1g/mL=100g,温度变化的值为![]() ,则生成0.025mol水放出的热量为Q=mc
,则生成0.025mol水放出的热量为Q=mc![]() =100g
=100g![]() 4.18J/(g
4.18J/(g![]() )=1421.2J,即1.4212kJ,所以实验测得的中和热
)=1421.2J,即1.4212kJ,所以实验测得的中和热![]() ;
;
(3)反应放出的热量和所用酸以及碱的量的多少有关,若改用60mL0.25mol/L的H2SO4和50mL0.55mol/L的NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量增加,因此与上术实验相比,所放出的热量不相等;改变酸和碱的用量,反应中放出的热量会变化,但反应热是不变的,因为中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关。故答案为相等;中和热是指酸跟碱发生中和反应生成1 mol H2O时所放出的热量,与酸碱的用量无关;
(4)a.实验装置保温、隔热效果必须好,否则放出的热量偏小,故正确;b.用温度计测定NaOH溶液起始温度后,要将温度计回零后再测定H2SO4溶液的温度,否则放出的热量偏小,故正确;c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把把NaOH溶液倒入盛有硫酸的小烧杯中,否则会导致较多热量散失,放出的热量偏小,故正确;d.根据以上分析可知将以上四实验测量温度均纳入计算平均值会导致反应放出的热量偏多,故错误。答案选abc。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中互为同系物的是( )
A. CH3—CH2—CH3和CH3—CH2—CH2—CH2—CH3B. CH3—CH3和CH3—CH![]() CH2
CH2
C. CH3—CH2—CH3和CH3—CH![]() CH2D. CH3—CH2—CH
CH2D. CH3—CH2—CH![]() CH2 和CH3—CH2—CH2—CH3
CH2 和CH3—CH2—CH2—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
选项 | ① | ② | ③ | ④ |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CS2 | 蔗糖 | H2CO3 |
A.①B.②C.③D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是

A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下:

根据设计要求回答:
(1)B装置有三种功能:①控制气流速度; ②均匀混合气体; ③____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x取值范围________。
(3)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置中除生成盐酸外,还含有有机物,从E中分离出有机物的最佳方法为________。
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
A CH4 B CH3Cl C CH2Cl2 D CHCl3 E CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,1.68L无色的可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到白色沉淀质量为15g;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)燃烧产物中水的质量为_______ g。
(2)若原气体是单一气体,则其分子式为_____________________。
(3)若原气体是由两种等物质的量的气态烃组成的混合物,请写出他们的分子式__________________。(请写出两组)
(4)若原气体是由两种等物质的量的气体组成的混合物,其中只有一种是烃,请写出他们的分子式____________________________。(请写出两组)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________;K、F、Zn的电负性从大到小的顺序为___________。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________。
(3)OF2分子的几何构型为___________,中心原子的杂化类型为___________。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为___________个。
②晶胞中紧邻的两个F-间的距离为_______________________(列出算式即可)nm。
③该晶体的密度为___________(列出算式即可,用NA表示阿伏加德罗常数的数值)g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com