
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率______________(填“升高”或“降低”),△H_____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=______________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
【答案】 降低 < 0.042 4.0 BC 2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 — 12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
CH3OCH3(g)+3H2O(g) △H=-122.7 kJ·mol-1 CH3OCH3 — 12e- + 16OH- = 2CO32- + 11H2O 1:2或0.5 0.11mol/L
【解析】(1)①由20min平衡时NO、N2、CO2的浓度之比为0.40:0.80:0.80=1:2:2,30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,可知升高温度平衡逆向移动,达到新平衡时NO的转化率降低,正反应为放热反应,△H<0,故答案为:降低;<;
②该反应在0-10min的平均反应速率v(N2)= ![]() =0.042molL-1min-1;由表格数据可知,20min达到平衡状态,则
=0.042molL-1min-1;由表格数据可知,20min达到平衡状态,则
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
开始2.0 00
转化1.6 0.80.8
平衡0.04 0.8 0.8
该反应的平衡常数K=![]() =4;故答案为:0.042;4;
=4;故答案为:0.042;4;
③A.加入合适的催化剂,平衡不移动,与图像不符,故A不选;B.适当缩小容器的体积,平衡不移动,但浓度均增大,与图像符合,故B选;C.通入一定量的NO,平衡正向移动,反应物、生成物浓度均增大,与图像符合,故C选;D.加入一定量的活性炭,平衡不移动,与图像不符,故D不选;故答案为:BC;
(2)①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1=-49.1kJmol-1,②2CH3OH(g)
CH3OH(g)+H2O(g)△H1=-49.1kJmol-1,②2CH3OH(g) ![]() CH3OCH3(g)+H2O(g)△H2=-24.5kJmol-1,结合盖斯定律可知,①×2+②得到2CO2(g)+6H2(g)
CH3OCH3(g)+H2O(g)△H2=-24.5kJmol-1,结合盖斯定律可知,①×2+②得到2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g),△H=(-49.1kJmol-1)×2+(-24.5kJmol-1)=-122.7kJmol-1,即热化学方程式为2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g),△H=(-49.1kJmol-1)×2+(-24.5kJmol-1)=-122.7kJmol-1,即热化学方程式为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.7kJmol-1,故答案为:2CO2(g)+6H2(g)
CH3OCH3(g)+3H2O(g)△H=-122.7kJmol-1,故答案为:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=-122.7kJmol-1;
CH3OCH3(g)+3H2O(g)△H=-122.7kJmol-1;
(3)二甲醚氧气电池(电解质为KOH溶液),负极上CH3OCH3失去电子生成碳酸根离子,负极反应是为CH3OCH3-12e-+16OH-═2CO32-+11H2O,故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
(4)①若某次捕捉后得到pH=10的溶液,则溶液酸碱性主要由CO32-+H2O![]() HCO3-+OH-,K=
HCO3-+OH-,K=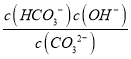 =
=![]() ,则
,则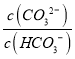 =
=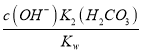 =
=![]() =0.5,故答案为:0.5;
=0.5,故答案为:0.5;
②4.66gBaSO4的物质的量为![]() =0.02mol,根据CO32-+BaSO4
=0.02mol,根据CO32-+BaSO4![]() BaCO3+ SO42-,K=
BaCO3+ SO42-,K=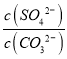 =
=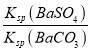 =0.1,反应后溶液中c(SO42-)=
=0.1,反应后溶液中c(SO42-)=![]() =0.01mol/L,则平衡时c(CO32-)=0.1mol/L,因此开始时Na2CO3溶液的物质的量浓度至少为0.1mol/L+0.01mol/L=0.11 mol/L,故答案为:0.11mol/L。
=0.01mol/L,则平衡时c(CO32-)=0.1mol/L,因此开始时Na2CO3溶液的物质的量浓度至少为0.1mol/L+0.01mol/L=0.11 mol/L,故答案为:0.11mol/L。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】属于氧化还原反应的离子方程式的是( )
A.CaCO3+2H+= Ca2++CO2↑+H2OB.2Fe2++Cl2= 2Fe3++2Cl-
C.HCO3-+H+= CO2↑+H2OD.2Na+2H2O = 2Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
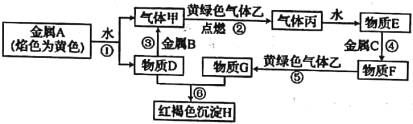
【题目】现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间的转化如图所示(金属B的氧化物可用作耐火材料,图中某些反应的产物及条件没有全部标出)。
回答下列问题:
(1)金属单质A、B、C分别为_____、_________、_________ (写化学式)。
(2)反应②的实验现象是________________________。
(3)反应③的化学方程式为___________。
(4)反应⑤的离子方程式为___________。
(5)⑥的反应类型是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
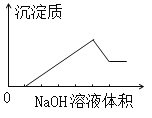
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的2L密闭容器,进行反应2X(g)+Y(g)2Z(g),若起始时X、Y、Z物质的量分别为n1、n2、n3(均不为零).达平衡时,X、Y、Z浓度分别为0.2mol/L、0.1mol/L和0.08mol/L,则下列判断合理的是( )
A.X和Y的转化率不一定相等
B.n1、n2=2:1
C.平衡时,Y和Z的生成速率之比为2:1
D.n,的取值范围为0<n1<0.28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示某可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是
2NH3(g) △H在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法正确的是

A. 反应物的总键能小于生成物的总键能
B. 如果对上述反应加压,平衡正向移动,△H减小
C. a与b相比,反应的平衡常数一定不同
D. a与b相比,a的反应速率更快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使醋酸溶液中的CH3COO﹣浓度增大,电离平衡向右移动,且不放出气体,可向醋酸溶液中加入少量固体( )
A.NaOH
B.NaHCO3
C.CH3COOK
D.Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com