
����Ŀ�����Ȼ�ͭ���壨CuCl22H2O���к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ�������ˮ��������������Ƴ�ˮ��Һ��Ȼ����ͼ��ʾ�IJ�����������ᴿ��
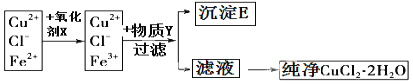
��֪�����£����и����ʵ�KSP��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25 ��) | 8.0��10��16 | 2��10��20 | 4.0��10��38 |
��1���������ʶ�������Ϊ���������������ʺϱ�ʵ����� ��
A��H2O2 B��KMnO4 C��HNO3 D��K2Cr2O7
д������ѡ�õ��������ڸ�ʵ���еķ�����Ӧ�����ӷ���ʽ�� ��
��2������Y�� ������E�Ļ�ѧʽ ��
��3������Һ�õ�������CuCl22H2O����Ӧ���õķ����� �����ˡ�ϴ�ӡ�
��4���������Y֮��Cu2+��Ũ��Ϊ0.02 mol/L��Ҫʹ Cu2+��ˮ�⣬�����Y����Һ��pH���ܳ��� ��
���𰸡���1��A��2Fe2++H2O2+2H+=2Fe3++2H2O��
��2��CuO��Cu(OH)2����CuCO3����Fe(OH)3
��3���������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ��
��4��5
��������
�����������ȡ����Ϊ�������������ӵ���Һ�м���������X�����������������������ӣ�Ȼ�����Y������Һ��pH��ʹ��������ȫת�����������������������Y���������µ����ʣ�����Y����ΪCuO��Cu(OH)2��CuCO3����ȥ���ʺ����ҺΪ�Ȼ�ͭ��Һ������Һ��HCl�������е��¼����������õ��Ȼ�ͭ���壬
��1����������ṩ��Ϣ��֪Fe3+���������pH��С������Ӧ�Ƚ�Fe2+����ΪFe3+���ٽ����ȥ�����ݿ�ͼ������������X�ɰ�Fe2+����ΪFe3+����û�����������ʣ�����X����ΪH2O2��B������K+��Mn2+��C���������������ӣ�D����������ӡ������ӡ�������Ӧ���ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ʴ�Ϊ��A��2Fe2++H2O2+2H+=2Fe3++2H2O��
��2�������ʾ������pH4��5��ʹFe3+ȫ��������ͬ�������������ʣ�����Y���ΪCuO��Cu(OH)2��CuCO3����ȥFe3+���й����ӷ���ʽFe3++3H2OFe(OH)3+3H+��CuO+2H+�TCu2++H2O����ʹ�����������ɳ����ķ����ƶ���
�ʴ�Ϊ��CuO��Cu(OH)2����CuCO3����Fe(OH)3��
��3��CuCl2����ǿ�������Σ���������ʱ�ٽ���ˮ�⣨HCl�ӷ���������Ӧ�������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ�������ˡ�ϴ�ӵȵķ������õ�CuCl22H2O�ľ��塣
�ʴ�Ϊ���������ᣬ����Ũ������ȴ�ᾧ�������Ȼ�������������Ũ������ȴ�ᾧ����
��4���������֪��Cu(OH)2��Ksp=2.0��10-20����ʱ[c(OH-)]2=2.0��10-20/0.02=1��10-18��c(OH-)=1��10-9��c(H+)=1��10-5������ҺpH=5��Ҫʹ Cu2+��ˮ�⣬�����Y����Һ��pH���ܳ���5��
�ʴ�Ϊ��5��


 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������M�п��ܺ���Al2O3��Fe2O3��Al��Cu��Ϊȷ������ɣ�ijͬѧ�����ͼ��ʾ����������

���з�����ȷ����
A����m1>m2ʱ��������M��һ������Al2O3
B��������ɫ��Һ�����ӷ���ʽΪ��Cu+Fe3+=Cu2++Fe2+
C������B�ȿ���ʹ������ֿ����ǻ����
D��Ҫȷ�������M���Ƿ���Al����ȡM������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܵĴ洢������Ӧ�õ���Ҫƿ������λ�⻯��������廯������Ŀǰ�����õ���Ҫ������ϡ�
��1��Ti��BH4��2��һ�ֹ���Ԫ�����⻯�ﴢ����ϡ���̬Tiԭ�ӵ���ռ�ݵ�����ܲ�����________����̬Ti2+���۵����ĵ����Ų�ʽ ��
��2��Һ���Ǹ������ʣ������ܵ��������壬����N2+3H22NH3ʵ�ִ�������⣮����˵����ȷ����_________������ţ���
a��NH3�����е�ԭ�ӵĹ���ӻ���ʽΪsp2�ӻ�
b��NH4+��C1O4-��PH4+��CH4��BH4-��Ϊ�ȵ�����
c����ͬѹǿʱ��NH3�ķе��PH3�ķе��
d���縺��C<N<O , ��һ������C< O < N
��3��Se��Oͬ�壬�� SeO2���ӵĿռ乹��Ϊ
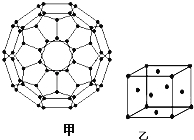
��4������ϩ��C60���Ľṹ��ͼ�ף�������̼ԭ�ӹ�����ӻ�����Ϊ ��1mol C60�����ЦҼ�����ĿΪ ����
��5��ͼ��Ϊһ������ͭ�ľ������˾���������ı߳�Ϊa pm��Cu�����ԭ������Ϊ64������ͭ���ܶ�Ϊ�� g/cm3�����ӵ������ɱ�ʾΪ mol��1���ú�a���ѵĴ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��δ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ�����������������δ������Դ�����ǣ������� ����Ȼ�� ��ú �ۺ��� ��ʯ�� ��̫���� ���������� �߷��� �����ܣ�
A.�٢ڢۢ�
B.�ݢޢߢ�
C.�٢ۢݢޢߢ�
D.�ۢܢݢޢߢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ�ȵ���������ȷ����( )
A����֪2H2(g)��O2(g)===2H2O(g) ��H����483.6 kJ��mol��1����������ȼ����Ϊ241.8 kJ��mol��1
B��X(g)��Y(g)![]() Z(g)��W(s) ��H>0�������¶ȣ��÷�Ӧ�Ħ�H����
Z(g)��W(s) ��H>0�������¶ȣ��÷�Ӧ�Ħ�H����
C����֪��S(s)��O2(g)=SO2(g) ��H1��S(g)��O2(g)=SO2(g) ��H2 �� ��H1>��H2
D�����м���1 g SO2��1 g O2�����м���2 g SO2��2 g O2���ں��º��ݻ���º�ѹ�·�Ӧ2SO2(g)��O2(g)![]() 2SO3(g)��ƽ��ʱ���ҷų������������ڼ�2��
2SO3(g)��ƽ��ʱ���ҷų������������ڼ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���224 L HCl��������635 mLˮ�У�����������ܶ�Ϊ1.18g��cm��3���Լ��㣺
��1������������������������ʵ���Ũ�ȷֱ���________��________��
��2��ȡ����������100 mL��ϡ����1.18 L������ϡ��������ʵ���Ũ����________��
��3����40.0 mL 0.065 mol��L��1 Na2CO3��Һ�У����루2����ϡ�͵�ϡ���ᣬ�ӱ�����ʹ��Ӧ������CO2���壬����ϡ��������������________mL��
��4����������NaOH��Ʒ1 g(��Ʒ������Na2CO3��ˮ)������50 mL 2 mol��L��1�������У���ַ�Ӧ����Һ�����ԣ��кͶ����������ȥ40 mL 1 mol��L��1��NaOH��Һ�������кͺ����Һ�����յõ�________�˹��塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У������� ������ ���ܽ� ��ȡҺ���Լ� ��ȡ�����Լ���һ��Ҫ�õ�����������
A. �٢ڢ� B. �ܢ� C. �٢� D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�ԭ�ӻ����ӵĵ����Ų�ʽ��ȷ���ǣ�������
A.Al��1s22s22p63s2
B.O2����1s22s22p6
C.Na+��1s22s22p63s1
D.Si��1s22s22p63s23p4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧʵ��̽�������Ļ�ԭ�Բ�����ϵ��ʵ�顣
��1�����������Ϻ�ɫͭ˿�Ƽ�Ȧ���ھƾ��ƻ����ϼ��ȣ���ͭ˿��ں��Ƚ�ͭ˿�������ɵ��Ȼ�茶�������̷����а�ɫ�������ɣ��ó�ͭ˿��ͭ˿��ת��Ϊ�������Ϻ�ɫ���ں���ͭ��ʱ���Ȼ�麟�ȥͭ�����������ͭ�������˸�ԭ��������ɸ÷�Ӧ��
______CuO+_____NH4Cl=_____Cu+CuCl2+___________N2��+_______( )
��2����������װ�ã����������������MxOy��Ӧ����M��H2�� H2O��ͨ����������ˮ���������ⶨM�����ԭ��������a���Լ���Ũ��ˮ��
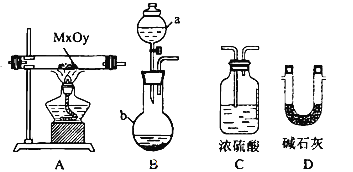
������a������Ϊ________������b��װ����Լ�������______��
�ڰ�����������ȷ��װ�����ӣ�����ţ�װ�ÿ��ظ�ʹ�ã���________��
��ʵ�����ʱ��Ӧ����_______������ţ���
I��Ϩ��Aװ�õľƾ���
II.ֹͣ��a�еμ�Һ��
����ʵ����ȷ��ȡ���������������Ϊmg,��ȫ��Ӧ�������ˮ������Ϊng����M�����ԭ������Ϊ_____(��x��y��m��n��ʽ�ӱ�ʾ)��
��3��������������MxOyΪFe2O3,����Ӧ���������ϡ���ᣬȻ��μ�KSCN����û�������Ա仯���Ʋ�ù���ɷֿ�����(����ѧʽ�����±�������Ϊ�м��ֿ������)��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com