
����Ŀ��ij��ѧС���������������������װ�ã�����ͼ�����Ի������Ʊ�����ϩ��
��֪��
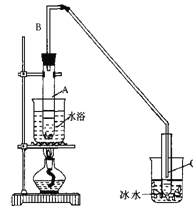
��1���Ʊ���Ʒ:��12.5mL�����������Թ�A�У��ټ���1mLŨ���ᣬҡ�Ⱥ�������Ƭ��������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������_______������B���˵�������е�������_________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����_______________________________________
��2���Ʊ���Ʒ
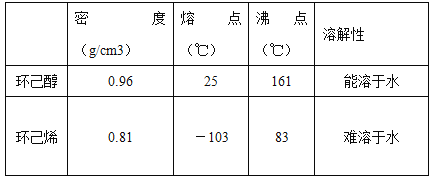
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��_______�㣨��ϡ����¡� ������Һ����______�������ţ�ϴ�ӡ�
A��KMnO4��Һ B��ϡH2SO4 C��Na2CO3��Һ
���ٽ�����ϩ����ͼװ��������ȴˮ��_______�ڽ��롣����ʱҪ������ʯ�ң�Ŀ����________________________��
���ռ���Ʒʱ�����Ƶ��¶�Ӧ��_________�����ҡ�
���𰸡���1���ٷ�ֹ�����������ڷ�ֹ����ϩ�Ļӷ�
��2������ C ��g ��ȥˮ�֢�83��
��������
�����������1����װ��A�����Ƭ�������Ƿ�ֹ���У��������ɵĻ���ϩ�ķе�Ϊ83�棬Ҫ�õ�Һ̬����ϩ������B���˵���������������ã����ڻ���ϩ������
�ڱ�ˮԡ��Ŀ���ǽ��ͻ���ϩ�������¶ȣ�ʹ��Һ������ֹ����ϩ�ӷ���
��2���ٻ���ϩ�����࣬�������Ȼ�����Һ�����ܶȱ�ˮС�������á��ֲ��ϩ���ϲ㣬���ڷ�Һ��ϩ��Ʒ�л�������������ͻ���������Na2CO3��Һϴ�ӿɳ�ȥ��
��Ϊ����������Ч��������װ��Ҫ�������ܣ���ȴˮ���¿ڣ�g�����룬����ʱ������ʯ�ң�Ŀ���dz�ȥˮ����
�۸��ݱ������ݿ�֪����ֻ���ϩ�ķе�Ϊ83�棬���ռ���ƷӦ�����¶���83��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
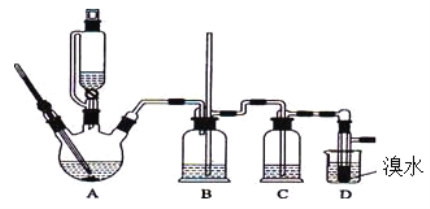
����Ŀ����ʵ��������������ˮ���������Ҵ��Ʊ�1,2-���������װ������ͼ��ʾ��
�й������б����£�
�Ҵ� | 1,2-�������� | �� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶȣ�g��cm-3 | 0.79 | 2.2 | 0.71 |
�е㣯�� | 78.5 | 132 | 34.6 |
�۵㣯�� | -l30 | 9 | -1l6 |
�ش��������⣺
��1����ƿA�з�������Ҫ�ķ�Ӧ����ʽ ��
��2��װ��B��������__________________________��
��3����װ��C��Ӧ���� ������ĸ����
a��ˮ b��Ũ���� c������̼��������Һ d������������Һ
��4����������������δ��Ӧ��Br2������� ������ĸ��ϴ�ӳ�ȥ��
a��ˮ b������������Һ c���⻯����Һ d���Ҵ� e��Na2SO3��Һ
��5�������������������������ѣ����� �ķ�����ȥ��
��6����Ӧ������Ӧ����ˮ��ȴװ��D�����ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ����
��
��7���жϸ��Ʊ���Ӧ�Ѿ�������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��3A(g)+B(g) ![]() 2C(g) +2D(g) �ڲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ��
2C(g) +2D(g) �ڲ�ͬ�����µķ�Ӧ���ʷֱ�Ϊ��
��1��v(A)=0.6molL-1min-1 ��2�� v(B)=0.007 molL-1S-1
��3��v(C)=0.4 molL-1min-1 ��4�� v(D)=0.80 molL-1min-1
�˷�Ӧ�ڲ�ͬ�����½��������� �� ��
A��(1) B����2�� C����3�� D����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½�0.04��������������ˮ���Ƴ�100 mL��Һ���ʵ���Ũ��Ϊ____mol/L�� pHΪ______��Ҫʹ����pH��Ϊ11��(������Һ����������ϡ��ǰ��Һ�����֮��)����������ˮ��Ӧ��________mL��������pHΪ10��NaOH��Һ��Ӧ��______mL��������0.01 mol��L��1�����ᣬӦ��________mL(������λ��Ч����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ����ճ����������Ź㷺��Ӧ�á�
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ��CO��g����2H2��g��![]() CH3OH��g�� ��H1
CH3OH��g�� ��H1
��Ӧ��CO2��g����3H2��g��![]() CH3OH��g����H2O��g����H2
CH3OH��g����H2O��g����H2
���������Ʊ��״���������Ӧ�У���Ӧ�����ڷ�Ӧ��ԭ��Ϊ_________________��
�ڷ�Ӧ���У�����H1��0����Ҫ��״��IJ��ʣ��ɲ�ȡ�Ĵ�ʩ��_____������ĸ��
A����С��������� B�������¶� C�������¶�
D��ʹ�ú����Ĵ��� E�����״��ӻ����ϵ�з������
��2����֪�ڳ��³�ѹ�£�
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l�� ��H1=��1453kJ/mol
��2CO��g��+O2��g��=2CO2��g�� ��H2=��466kJ/mol
��д��32g�״�Һ�巢������ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ�� ��
����CO2��H2�ϳ�CH3OH�ķ�Ӧ���£�CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H����10L�ĺ����ܱ�������Ͷ��1 mol CO2��2.75 mol H2���ڲ�ͬ�����·���������Ӧ�����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
CH3OH��g��+H2O��g����H����10L�ĺ����ܱ�������Ͷ��1 mol CO2��2.75 mol H2���ڲ�ͬ�����·���������Ӧ�����ƽ��ʱ�״������ʵ������¶ȡ�ѹǿ�ı仯��ͼ��ʾ��
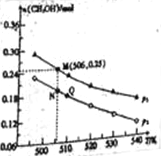
��������Ӧ�ġ�H ���������������0
��ͼ��ѹǿp1 ���������������p2
�۾��ⶨ֪Q��ʱ������ѹǿ�Ƿ�Ӧǰѹǿ��0.9������Ӧ����ʼ��ƽ�������ʱ��Ϊ10min����0~10min��H2�ķ�Ӧ����v(H2)= ��
��N��ʱ���÷�Ӧ��ƽ�ⳣ��K= ������������2λС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ���Ҷ�ú��ʯ(��Ҫ��Al2O3��SiO2��Fe2O3)�Ʊ��ۺ��Ȼ���{[Al2(OH)nCl6��n]m(1��n��5��m��10)�����PAC����һ�����͡���Ч���������;�ˮ��}���乤���������£�

��ش��������⣺
��1����Ũ��������20%����������IJ���������______________________________��
��2����20%������������йط�Ӧ�����ӷ���ʽΪ_____________________________��
��3������2����Ҫ�ɷ��ǣ����ʵ��֤����Ľ���(�����������):_____________________��
��4���ɳ����PACϡ��Һ��þۺ��Ȼ������壬��ʵ�������_________________���õ���PAC�ֲ�Ʒ�п��ܺ��е�����������____________��
��5���Ӳ��������ʵĽǶ������ǣ�������ҺpH���Լ��ɸ�Ϊ________(����ĸ)��
A��NaOH B��Al C����ˮ D��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��п���仯������;�㷺������п����п����Ҫ�ɷ���ZnS��Ϊ��Ҫԭ�ϣ��漰����Ҫ��Ӧ�У�
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) ![]() H1=��930 kJ��mol��1
H1=��930 kJ��mol��1
2C(s) + O2(g) = 2CO(g) ![]() H2=��221 kJ��mol��1
H2=��221 kJ��mol��1
ZnO(s) + CO(g) = Zn(g) + CO2(g) ![]() H3=198 kJ��mol��1
H3=198 kJ��mol��1
��ӦZnS(s) + C(s) + 2O2(g)��Zn(g) + CO2(g) + SO2(g)��![]() H4= kJ��mol��1��
H4= kJ��mol��1��
��2����Ӧ�����ɵ�CO2��NH3�������һ�������·�Ӧ�ϳ�������
2NH3��g��+CO2��g��![]() CO��NH2��2��s��+H2O��g����H��0
CO��NH2��2��s��+H2O��g����H��0
���÷�Ӧ��һ���¡������ܱ������ڽ��У��жϷ�Ӧ�ﵽƽ��״̬�ı�־�� ��
a��CO2��H2O(g)Ũ����� b�������������ѹǿ���ٸı�
c��2v(NH3)�� = v(H2O)�� d�������л��������ܶȲ��ٸı�
������߰�����ת���ʣ����Բ�ȡ�Ĵ�ʩ�� ��д��������
��3������п�ɹ㷺����ӡȾýȾ����ľ�ķ�������ZnSO4���ȷֽ�����и��������ʵ������¶ȱ仯��ϵ��ͼ��ʾ��
��700����980��ʱ������Ӧ���������ʶ�������ZnO����������÷�Ӧ��2L�ܱ������ڽ��У�10minʱ��������ɵ����������ʵ���Ϊ0.3mol�������ʱ������������������Ϊ ��
�� ����п�ֽ����ɵ�SO2����ͼ�е�ѭ���ɵõ�H2SO4��ѭ���е�����������Ӧʽ�� ��


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
��������ͼ��ʾ������˵����ȷ���ǣ� ��

A��a��c����ķ�Ӧ���ʣ�a��c
B��a��b�����ת���ʣ�a��b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ������������������ֶ�����Ԫ���е����ֻ�������ɵ�5�ֻ���������ҡ��������������Ԫ����ɣ����ǵ�������ЧӦ����Ҫ���壬������Ȼ������Ҫ�ɷ֣��ҺͶ����������ᷴӦ��������ǿ����Һ��Ӧ������5�ֻ������漰������Ԫ�ص�ԭ������֮�͵���28������һ�ֽ���Ԫ�غ����ַǽ���Ԫ����ɣ���ԭ�Ӹ�����Ϊ1�U3�U9������ԭ����������������н���Ԫ�ص�ԭ������������֮��ķ�Ӧ��ϵ����ͼ��

��ش���������:
��1�����ʼĻ�ѧʽ�� ��д���ҵ�һ����;�� ��
��2����������H2O��Һ��Ӧ�Ļ�ѧ����ʽ ��
��3���������ı�ͨ��ij�����ʵ�ˮ��Һ�п������ɶ����÷�Ӧ�����ӷ���ʽΪ ��
��4��������ijǿ����Һ�����ӷ���ʽΪ ��
��5����200 mL 1.5 mol��L-1NaOH��Һ��ͨ���״����4.48 L �����壬��ȫ��Ӧ��������Һ�У���������Ũ���ɴ�С��˳���� ��
��6������һ���������ʣ����ܶȻ�����Ϊ1.25��10-33����0.01 mol ��Ͷ��1 LijŨ�ȵ������У�Ϊʹ����ȫ�ܽ�õ���������Һ���������Ũ������ӦΪ ������仯���Բ��ƣ����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com