
【题目】热化学方程式2H2(气) + O2(气) = 2H2O(气) + 483.6 kJ/mol ,化学计量(系数)表示的是
A. 体积数 B. 物质和质量 C. 物质的量 D. 物质的质量
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时。电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极。碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理如图所示,其总反应式为H2+2NiOOH![]() 2Ni(OH)2以下说法正确的是
2Ni(OH)2以下说法正确的是
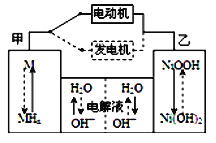
A. 混合动力车上坡或加速时,乙电极为负极
B. 混合动力车在刹车或下坡时,乙电极的电极反应式为Ni(OH)2+OH--e-==NiOOH+H2O
C. 混合动力车上坡或加速时,电解质溶液中的OH-向乙电极周围移动
D. 混合动力车上坡或加速时,乙电极周围溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵是一种重要化工产品,常温时,为白色晶体或粉末,易溶于水,难溶于CCl4,59℃时分解为氨及二氧化碳,其制备原理:2NH3(g)+CO2(g)![]() NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
NH2COONH4(s)△H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
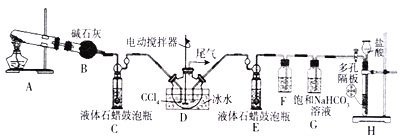
(1)仪器组装完毕后,首先应进行的操作是_____________________________。
(2)装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为_____________。
(3)装置F中试剂的名称为_________,装置G的作用为________________。
(4)为提高原料气的利用率,应控制装置C和E中最佳鼓泡速率比为____________,装置D采用冰水浴的原因为_____________________________________________________。
(5)生成的氨基甲酸铵悬浮于CCl4中,下列操作可实现产品分离的是_________。
![]()

(6)实验装置中存在明显不足之处的是______________,有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A. 在NaClO和NaCl的混合溶液中,Ag+、K+、NO3-、I-可以大量共存
B. Kw/C(H+) =1×10-13mol·L-1的溶液中: NH4+、Ca2+、Cl-、NO3-
C. ![]() 在溶液中能大量共存,通过量
在溶液中能大量共存,通过量![]() 后仍能大量共存
后仍能大量共存
D. 水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、Al![]() 、C
、C![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)实验室常用A的饱和溶液制备微粒直径为1nm-100nm的红褐色液相分散系。则该反应的化学方程式为:_________________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,4mol/L的B溶液中逐滴滴入100mL 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为_________________________。
(3)将A、B中两种金属元素的单质用导线连接,插入同一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:_____________________________________。
(4)C是常见温室气体,将一定量的气体C通入100mL某浓度的KOH溶液得溶液F,向F溶液中逐滴加入2 mol·L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。

则F 溶质与足量石灰水发生反应最多可得沉淀的质量为_______________g。
(5)pH=3.6时,碳酸钙与硫酸铝反应可制备碱式硫酸铝[Al2(SO4)x(OH)6-2x]溶液。若溶液的pH偏高,则碱式硫酸铝产率降低且有气体C产生,用化学方程式表示其原因: ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. C3H8中碳原子都采用的是sp3杂化
B. O2、CO2、N2都是非极性分子
C. 酸性:H2CO3<H3PO4<H2SO4<HClO
D. CO的一种等电子体为NO+,它的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素在生物体内含量虽少,却是生命活动不可缺少的,可通过下面哪些实例得到证明( )
A. Mg2+是叶绿素的组成成分 B. 缺N会影响蛋白质的合成
C. 哺乳动物血液中Ca2+的含量太低会出现抽搐 D. 油菜缺少硼,会只开花不结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
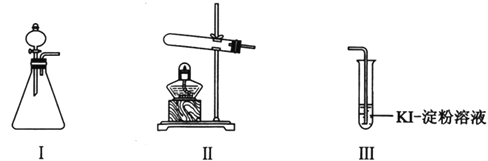
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向I的锥形瓶中加入______,.向I的______中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式是__________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是___________。为进一步探究该条件对反应速率的影响,可采取的实验措施是________。
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。
A.酸性 KMnO4 B. FeCl2 C. Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)________________________造成的,请设计实验证明他们的猜想是否正确________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C 具有______性。(填氧化性或还原性)
(2)我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3 CO2↑。该反应的氧化剂是____,当16g 硫参加反应时,转移的电子数为__________。
(3)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。上述反应中,若有10个铝原子参与反应,则转移的电子数为__________个,用“双线桥法”标明反应中电子转移的方向和数目_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com