
【题目】燃料电池是利用燃料(如H2、CO、CH4、CH3OH、NH3等)与O2反应从而将化学能转化为电能的装置。
(1)燃料电池(NaOH作电解质溶液)的正极电极反应式为__。
瑞典ASES公司设计的曾用于驱动潜艇的液氨液氧燃料电池示意图如图所示,有关说法不正确的是(________)

A.电池工作时,Na+向正极移动
B.电子由电2经外电路流向电极1
C.电极总应为4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为O2+4H++4e-=2H2O
(2)葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

葡萄糖作为微生物燃料电池的___(填“正”或“负”)极。
微生物燃料电池___(填“能”或“不能”在高温下工作。
(3)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理所示,该装置中电解质为氧化钇一氧化钠,其中O2可以在固体介质NASICON中自由移动。传感器中通过电极反应测定尾气中CO的含量越高,请回答:

电极反应式为___。
(4)PbO溶解在HCl和NaCl的混合溶液中,得到含电解质Na2PbCl4溶液,电解Na2PbCl4溶液生成Pb的装置如图所示。

电解时阴的电极反应式___。
其过程中通过阳离子交换膜的离子主要为___。
过程中,Na2 PbCl4电解液浓度不断减小,为了恢复其浓度向阴极室加___(填化学式)。
【答案】O2+2H2O+4e-=4OH- BD 负极 不能 CO2e+O2═CO2 PbCl42+2e-═Pb+4Cl H+ 继续向阴极区加PbO
【解析】
(1)燃料电池中燃料氢气在负极失电子发生氧化反应,氧气在正极上得到电子发生还原反应;液氨液氧燃料电池中,根据图示可知电极1上氨气转换为氮气,化合价升高,发生氧化反应,故电极1为负极,电极2为正极,燃料电池中,阳离子向正极移动,电子从负极移动到正极,在燃料电池的负极上发生燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应;碱性条件下,电极2发生的电极反应为O2+2H2O+4e-=4OH-,碱性溶液中不应该出现H+;
(2)葡萄糖为燃料的微生物燃料电池,通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳,在高温下,微生物会死亡,不能做微生物燃料电池;
(3)如图所示,反应本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极;b为正极,阴离子向负极移动,O2由电极b流向电极a,负极电极反应式为:CO2e+O2═CO2;
(4)根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42+2e-═Pb+4Cl,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极反应式为:2H2O4e═O2+4H+,质子交换膜可以允许氢离子向阳极移动,电解一段时间后,Na2PbCl2的浓度极大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO,
(1)氧气在正极上得到电子发生还原反应;燃料电池(NaOH作电解质溶液)的正极电极反应式为O2+2H2O+4e-=4OH-,液氨液氧燃料电池中,根据图示可知电极1上氨气转换为氮气,化合价升高,发生氧化反应,故电极1为负极,电极2为正极,
A. 燃料电池中的阳离子向正极移动,电池工作时Na+向正极移动,故A正确;
B. 燃料电池中,电子是从负极流向正极,电子由电极1极经外电路流向电极2,故B错误;
C. 燃料电池的总反应是燃料燃烧的化学方程式电极总应为4NH3+3O2=2N2+6H2O,故C正确;
D. 在燃料电池的负极上发生燃料失电子的氧化反应,在正极上氧气发生得电子的还原反应;碱性条件下,电极2发生的电极反应为O2+2H2O+4e-=4OH-,碱性溶液中不应该出现H+,故D错误;
故答案为:O2+2H2O+4e-=4OH-;BD;
(2)葡萄糖为燃料的微生物燃料电池,通氧气为生物燃料电池的正极;负极是葡萄糖失电子生成二氧化碳,在高温下,微生物会死亡,不能做微生物燃料电池,
故答案为:负极;不能;
(3)本质是CO与氧气反应生成CO2,CO在a极发生氧化反应,故a为负极;b为正极,阴离子向负极移动,O2由电极b流向电极a,负极电极反应式为:CO2e+O2═CO2,
故答案为:CO2e+O2═CO2;
(4)根据电化学原理可知,阴极发生还原反应,则Na2PbCl2得到电子生成Pb,电极反应式为:PbCl42+2e-═Pb+4Cl,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极反应式为:2H2O4e═O2+4H+,质子交换膜可以允许氢离子向阳极移动,电解一段时间后,Na2PbCl2的浓度极大减小,为了恢复其浓度且实现物质的循环利用,根据少什么加什么的原则,溶液中减少了Pb和O,应该在阴极区加PbO,
故答案为:PbCl42+2e-═Pb+4Cl;H+;继续向阴极区加PbO。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
(1)表示核素的符号共________种。
(2)互为同位素的是________和________。
(3)质量数相等,但不能互称同位素的是________和________。
(4)中子数相等,但质子数不相等的核素是________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁条、铝条平行插入一定浓度的NaOH溶液中,用导线连接构成原电池(如图所示),此电池工作时,下列叙述中正确的是( )
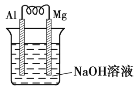
A.Mg比Al活泼,Mg失去电子被氧化成Mg2+
B.负极反应为Al-3e-+4OH-=![]() +2H2O
+2H2O
C.外电路中电子由Mg电极经导线流向Al电极
D.Al是正极,开始工作时溶液中会有白色沉淀析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:

(1)该密闭容器的容积是___。
(2)达到未平衡状态的时刻是___min(填“3”或“10”)。
(3)在前3min内,用H2浓度的变化表示的反应速率v(H2)=___mol/(L·min)。
(4)10min时体系的压强与开始时压强之比为__。
(5)达平衡后H2O(g)的物质的量分数是___。
(6)已知:①CO(g)+2H2(g)=CH3OH(g) △H=-90.1kJ/mol,②CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41.1kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式__,反应在10min内所放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
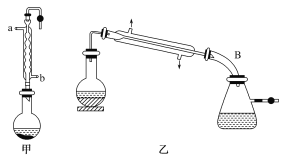
请回答下列问题:
(1)图甲中冷凝水从__(填“a”或“b”)进,图乙中B装置名称__。
(2)反应中加入过量的乙醇,目的是__。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:

则试剂a是__,分离方法Ⅰ是__,试剂b是__(填序号)。
A.浓盐酸 B.浓硫酸 C.浓硝酸
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果为:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是:___。
②乙实验失败的原因是:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“1.0 mol·L-1 NaCl溶液”的说法正确的是
A.该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B.若取该溶液50 mL,其中c(Cl-) = 0.05 mol·L-1
C.若取该溶液10 mL,恰好能与100 mL 0.1 mol·L-1 AgNO3溶液完全反应
D.该溶液与1.0 mol·L-1 Na2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体a通入溶液b中(装置如图所示),始终无明显变化的是

选项 | 气体a | 溶液b |
A | CO2 | CaCl2 |
B | Cl2 | KI |
C | SO2 | Ba(NO3)2 |
D | NO2 | FeSO4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com