
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
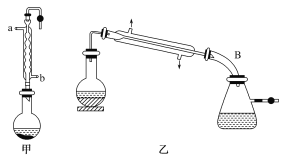
请回答下列问题:
(1)图甲中冷凝水从__(填“a”或“b”)进,图乙中B装置名称__。
(2)反应中加入过量的乙醇,目的是__。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下列框图是分离操作步骤流程图:

则试剂a是__,分离方法Ⅰ是__,试剂b是__(填序号)。
A.浓盐酸 B.浓硫酸 C.浓硝酸
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果为:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是:___。
②乙实验失败的原因是:__。
【答案】b 尾接管 提高乙酸的转化率 饱和Na2CO3溶液 分液 B 所加NaOH溶液不足,未将酸完全反应 所加NaOH溶液过量,酯发生水解
【解析】
本题主要考查乙酸乙酯的实验室制备的装置、除杂、分离,饱和碳酸钠溶液的作用,乙酸乙酯的水解条件的选择,只要将课本中的知识点掌握到位,就没有什么难度。
(1)冷凝管中的冷凝水是下进上出,即图甲中冷凝水从b进,从图乙中可知B装置名称是尾接管;
(2)由于制备乙酸乙酯的反应是可逆反应,加入过量的乙醇,目的是使平衡向着生成乙酸乙酯的方向移动,提高乙酸的转化率;
(3)由于试剂a要能够除去乙酸乙酯中的乙酸和乙醇等杂质,又尽量不减少乙酸乙酯的量,故可以用饱和碳酸钠溶液;方法Ⅰ分离后得到油层A和水层B,故进行的是互不相溶的液体,故用分液方法;水层B中主要含有乙醇和乙酸钠溶液,加入试剂b的目的是将乙酸钠转化为乙酸,由于浓盐酸、浓硝酸有挥发性,故选用浓硫酸;
(4)①甲得到了显酸性的酯的混合物,说明原来的乙酸并没有完全中和,甲实验失败的原因是加入的NaOH不足,酸未完全反应;
②乙酸乙酯是难溶于水的油状液体,乙得到了大量水溶性的物质,说明乙酸乙酯在碱性条件下完全水解成了易溶于水的乙醇和乙酸钠,乙实验失败的原因是加入的NaOH溶液太多了,是乙酸乙酯完全水解了。


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将锌、铜通过导线相连,置于稀硫酸中:
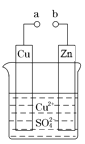
(1)锌片上的现象是______,电极反应为________。
(2)铜片上的现象是_________,电极反应为_________。
(3)电子由________经导线流向_____________。
(4)若反应过程中有0.2 mol电子发生转移,则生成的氢气在标准状况下的体积为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的铁和铜的混合物24g与600mL稀硝酸恰好完全反应,生成NO6.72L(标准状况)。向反应后的溶液中加入1molL-1NaOH溶液使金属离子恰好沉淀。下列有关说法错误的是( )
A.混合物溶解后的溶液中c(Fe3+):c(Fe2+)=1:1
B.稀硝酸的物质的量浓度度是2molL-1
C.需要加入NaOH溶液1000mL
D.最后所得沉淀在空气中充分加热可得固体32g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述正确的是
A.常温下,0.1mol·L-1 氨水的 pH=11: NH3·H2O NH4+ + OH-
B.Mg 和 Cl 形成离子键的过程: 
C.电解 CuCl2 溶液: CuCl2 == Cu2+ + 2Cl-
D.乙酸与乙醇发生酯化反应: CH3COOH + C2H518OH![]() CH3COOC2H5 + H218O
CH3COOC2H5 + H218O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如H2、CO、CH4、CH3OH、NH3等)与O2反应从而将化学能转化为电能的装置。
(1)燃料电池(NaOH作电解质溶液)的正极电极反应式为__。
瑞典ASES公司设计的曾用于驱动潜艇的液氨液氧燃料电池示意图如图所示,有关说法不正确的是(________)

A.电池工作时,Na+向正极移动
B.电子由电2经外电路流向电极1
C.电极总应为4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为O2+4H++4e-=2H2O
(2)葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

葡萄糖作为微生物燃料电池的___(填“正”或“负”)极。
微生物燃料电池___(填“能”或“不能”在高温下工作。
(3)CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理所示,该装置中电解质为氧化钇一氧化钠,其中O2可以在固体介质NASICON中自由移动。传感器中通过电极反应测定尾气中CO的含量越高,请回答:

电极反应式为___。
(4)PbO溶解在HCl和NaCl的混合溶液中,得到含电解质Na2PbCl4溶液,电解Na2PbCl4溶液生成Pb的装置如图所示。

电解时阴的电极反应式___。
其过程中通过阳离子交换膜的离子主要为___。
过程中,Na2 PbCl4电解液浓度不断减小,为了恢复其浓度向阴极室加___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛又名香兰素,是食品和药品的重要原料,其结构简式如图所示。下列有关香草醛的说法中不正确的是( )
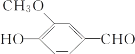
A.香草醛可以发生银镜反应
B.在一定条件下1mol香草醛可以与4molH2反应
C.香草醛遇FeCl3溶液可变色
D.香草醛可与NaOH溶液反应,也可与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种有机物有如下转化关系(部分产物和转化条件已略去);

已知烯烃A可以作为水果的催熟剂,D是食醋的成分之一。
请回答下列问题:
(1)写出B物质中官能团的名称_________。
(2)A在一定条件下与水反应能得到物质B,则该化学反应的反应类型是_____________。
(3)写出在浓硫酸作用下B与D反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________(填元素符号),该元素基态原子最外层电子的自旋状态___________(填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
化学键 | C-H | C-O | Si-H | Si-O |
键能/kJmol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
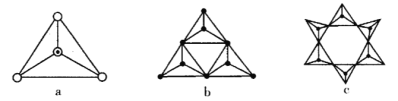
硅氧四面体中Si的轨道杂化类型为____________; 图b环状结构硅酸根的化学式为______________若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________,其晶格能可通过下图的Borm-Haber循环计算得到。

从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______kJ/ mol,KBr的晶格能为______kJ/mol,晶格能越大,该晶体的熔点越______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
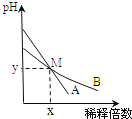
A.稀释前,![]()
B.稀释前,A溶液中由水电离出的![]() 的浓度大于
的浓度大于![]()
C.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7
D.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com