
【题目】一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题:

(1)反应达到平衡时,平衡常数表达式K=__,升高温度,K值__(填“增大”“减小”或“不变”),该反应是___反应(填“吸热”或“放热”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)__。(用含相应字母的式子表示)
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() ,下列有关该体系的说法正确的是__(填选项字母)。
,下列有关该体系的说法正确的是__(填选项字母)。
A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快
C.甲醇的物质的量增加 D.重新平衡时n(H 2 )/n(CH 3 OH)增大
【答案】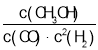 减小 放热
减小 放热 ![]() mol·L-1·min-1 BC
mol·L-1·min-1 BC
【解析】
(1)反应达到平衡时,平衡常数表达式K=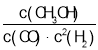 ,从图中可以找出,升高温度与K值变化的关系,从而确定平衡移动的方向及该反应的热效应。
,从图中可以找出,升高温度与K值变化的关系,从而确定平衡移动的方向及该反应的热效应。
(2)在500℃,从反应开始到平衡,由CH3OH的物质的量,可求出参加反应的H2的物质的量,从而求出氢气的平均反应速率v(H2)。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() 。
。
A.氢气的浓度增大,A错误;
B.正反应速率加快,逆反应速率也加快,B正确;
C.平衡正向移动,甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2 )/n(CH3OH)减小,D错误。
(1)反应达到平衡时,平衡常数表达式K=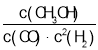 ,从图中可以找出,升高温度,K值减小,则平衡逆向移动,正反应为放热反应。答案为:
,从图中可以找出,升高温度,K值减小,则平衡逆向移动,正反应为放热反应。答案为: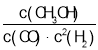 ;减小;放热;
;减小;放热;
(2)在500℃,从反应开始到平衡,n(CH3OH)=nB mol,则参加反应的H2的物质的量为2 nB mol,从而求出氢气的平均反应速率v(H2)=![]() =
= ![]() mol·L-1·min-1。答案为:
mol·L-1·min-1。答案为:![]() mol·L-1·min-1;
mol·L-1·min-1;
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的![]() 。
。
A.氢气的浓度增大,A错误;
B.正反应速率加快,逆反应速率也加快,B正确;
C.平衡正向移动,甲醇的物质的量增加,C正确;
D.重新达平衡时,H2的物质的量减小,CH3OH的物质的量增大,所以n(H2 )/n(CH3OH)减小,D错误。
则有关该体系的说法正确的是BC。答案为:BC。


科目:高中化学 来源: 题型:
【题目】合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
A. ①②③B. ④⑤C. ①⑤D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂在有机合成、电池等领域中有重要的作用。
I. ![]() 的制备和应用如下图所示。
的制备和应用如下图所示。

(1)锂元素在元素周期表中的位置_______________________。
(2)写出A的电子式___________________________。
(3)![]() 是有机合成中常用的还原剂,试写出反应③的化学方程式_________________。
是有机合成中常用的还原剂,试写出反应③的化学方程式_________________。
II.磷酸亚铁锂是新型锂离子电池的首选电极材料,是以铁棒为阳极,石墨为阴极,电解磷酸二氢铵、氯化锂混合溶液,析出磷酸亚铁锂沉淀,在800℃左右、惰性气体氛围中煅烧制得。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:

请回答下列问题:
(4)制备磷酸亚铁锂必须在惰性气体氛围中进行,其原因是_______________。
(5)阳极生成磷酸亚铁锂的电极反应式为___________________。
(6)写出M与足量氢氧化钠溶液反应的化学方程式_____________________。
(7)该电池充电时阳极的磷酸亚铁锂生成磷酸铁,则放电时正极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
CO2(g)+H2(g) △H<0,在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
A.升高温度,n(CO)减少B.减小压强,n(CO2)增加
C.更换高效催化剂,CO的转化率增大D.充入一定量的氮气,n(H2)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液。
(1)若滴定开始和结束时,酸式滴定管中的液面如图所示:则所用盐酸的体积为__mL。滴定终点时的现象是:当滴入最后一滴盐酸时,锥形瓶中溶液颜色由___,且30s不恢复原色。

(2)某学生根据三次实验分别记录有关数据如下表:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理数据算出该氢氧化钠溶液物质的量浓度(计算结果保留4位有效数字):c(NaOH)=__mol·L-1。
(3)由于错误操作,使得上述所测氢氧化钠溶液的浓度偏高的是__(填字母)。
A.滴定前滴定管中有气泡,滴定后消失 B.碱式滴定管量取NaOH溶液时,未进行润洗操作
C.滴定时达到滴定终点时俯视读数 D.锥形瓶取用NaOH待测液前加少量水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结 论 |
A | 向一定浓度的Na2SiO3 溶液中通入适量CO2 气体, 出现白色沉淀。 | H2SiO3 的酸性比H2CO3的酸性强 |
B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
C | 室温下,测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3- 结合H+ 的能力比SO32-的强 |
D | 分别向25mL冷水和25mL沸水中滴入6滴FeCl3 饱和溶液,前者为黄色,后者为红褐色。 | 温度升高,Fe3+的水解程度增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
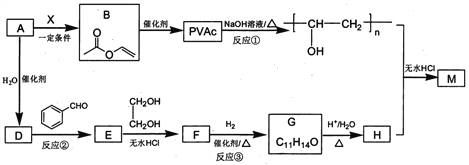
己知:R、Rˊ、Rˊˊ为H原子或烃基
I. R'CHO+ R"CH2CHO![]()
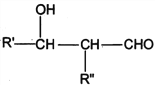
![]()
![]()
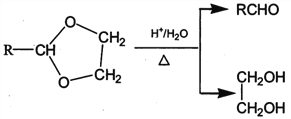
II. RCHO+![]()
![]()
(1)标准状况下,4.48L气态烃A的质量是5.2g,则A的结构简式为___________________。
(2)己知A→B为加成反应,则X的结构简式为_______;B中官能团的名称是_________。
(3)反应①的化学方程式为______________________。
(4)E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是_______________________。
(5)反应③的化学方程式为____________________________。
(6)在E→F→G→H的转化过程中,乙二醇的作用是__________________________。
(7)己知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Z是非金属元素,W、X的最高价氧化物对应的水化物可以相互反应生成盐和水,向一定量的W的最高价氧化物对应的水化物溶液中逐滴加入XZ3溶液,生成的沉淀X(OH)3的质量随XZ3溶液加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是()

A. d点对应的溶液中:K+、NH4+、CO32﹣、I﹣
B. c点对应的溶液中:Ag+、Ca2+、NO3﹣、Na+
C. b点对应的溶液中:Na+、S2﹣、SO42﹣、Cl﹣
D. a点对应的溶液中:Na+、K+、SO42﹣、HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com