
【题目】含Na2SO4、MgSO4和NaNO3的1 L混合溶液,已知其中c(Mg2+)= 0.4 mol· L-1,c(SO42-)= 0.7 mol· L-1,c(NO3-)=0.2 mol·L-1,则此溶液中c(Na+)为
A.0.2 mol·L-1B.0.4 mol·L-1
C.0.6 mol· L-1D.0.8 mol· L-1
科目:高中化学 来源: 题型:
【题目】(1)H2O的沸点高于H2S是因为________________;H2O分子比H2S分子稳定是因为__________________。
(2)Al和铁红发生铝热反应的化学方程式_________________,该反应的用途是_________________(任写一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:
3Fe2++2S2O![]() +O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. O2和S2O![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子数为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1﹕1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。A为_____,B为_____,C为_____,D的最高价氧化物的水化物是_____。 (用化学式填空)
Ⅱ.一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:
(1)反应开始到10 s,用Z表示的反应速率为_______________mol/(Ls)。
(2)反应开始到10 s,X的物质的量浓度减少了____________mol/L。
(3)反应的化学方程式为:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )

A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如下转化关系:
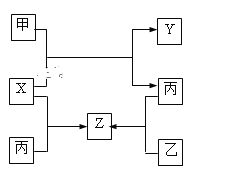
⑴若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体, 试推断:
①X的电子式是______________________________。
②X与甲反应的化学方程式______________________________________________。
⑵若甲是气体单质,丙通常是液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出Z的化学式_______________________。
②写出X与足量的甲在溶液中完全反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)反应I2+2S2O32-===2I-+S4O62-常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1 mL淀粉溶液作指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择____(填序号)。
①1 mL 0.01 mol·L-1的碘水 ②1mL0.001 mol·L-1的碘水
③4 mL 0.01 mol·L-1的Na2S2O3溶液 ④4mL0.001 mol·L-1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32-)=_____。
Ⅱ.一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应NO2(g)+SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
SO3(g)+NO(g),下列能说明反应达到平衡状态的是___。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO2的物质的量之比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
Ⅲ.已知2NO2(g)![]() N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
N2O4(g) ΔH<0。现将NO2和N2O4的混合气体通入恒温恒容为2升的密闭容器中,反应体系中物质浓度随时间的变化关系如图所示。
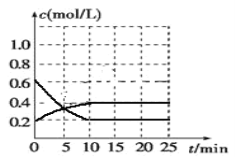
①平衡时NO2的转化率____;②起始压强与平衡时压强之比____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和碳的化合物与人类生产、生活密切相关。
(1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1
2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1
则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH=__________。
(2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①下列能说明该反应达到平衡状态的是________________。
a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化
c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变
②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=_______________________。
CH3OH(g)的平衡常数K=_______________________。

③在T1℃时,在体积为5 L的恒容容器中充入一定量的H2和CO,反应达到平衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当![]() 时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
时,达到平衡状态,CH3OH的体积分数可能是图象中的___________点。
(3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)

①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。

(4)如图所示的装置能吸收和转化NO2和SO2。
①阳极区的电极反应式为___________________________。
②阴极排出的溶液中含S2O![]() 离子,能将NO2气体转化为无污染气体,同时生成的SO
离子,能将NO2气体转化为无污染气体,同时生成的SO![]() 可在阴极区再生。写出该反应的离子方程式:___________________________。
可在阴极区再生。写出该反应的离子方程式:___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com