
【题目】一定温度下,对可逆反应A(g)+2B(g)3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.单位时间内消耗a molA,同时生成3a molCB.容器内B的浓度不再变化
C.混合气体的物质的量不再变化D.A的消耗速率等于C的生成速率的![]() 倍
倍
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
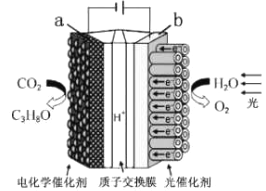
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的第三周期元素,已知A、B、E3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)D的原子结构示意图为___;E在元素周期表中的位置为___。
(2)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)___。
(3)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:___。
(4)写出A、B两元素最高价氧化物的水化物反应的化学方程式:___。
(5)E单质与水反应时,每1molE单质完全反应转移的电子数为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJmol1,
2H2(g)+O2(g)═2H2O(g) △H=484kJmol1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O) 是一种强还原剂,沸点118.5℃,熔点-40℃,常温下为无色透明的油状液体,属于二元弱碱,在空气中可吸收CO2而产生烟雾。水合肼的制备装置如图。
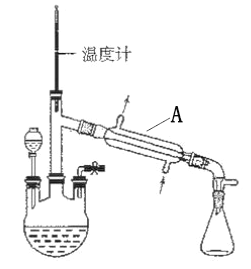
(1)装置A的名称为________________。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是______________________。
(2)水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为__________________。
(3)制备水合肼时,分液漏斗应盛装________(填标号)。理由是___________。
a.NaOH 和NaClO 混合溶液 b.CO(NH2)2 溶液
(4)弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为_____________。常温下Ksp[Cr(OH)3]= 10-32,且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=________。
(5)有同学认为该实验收集装置有缺陷。请你写出改进措施:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,若溶液中由水电离产生的c(H+)=1×10-12 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-B.K+、Na+、Cl-、NO3-
C.K+、Na+、HCO3-、NO3-D.K+、NH4+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.AlCl3溶液和Al2(SO4)3溶液蒸干、灼烧后所得固体的成分相同
B.配制FeCl3溶液时,将FeCl3固体溶解在H2SO4溶液中,然后再用水稀释到所需的浓度
C.用热碱液可以去油污
D.泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草图经》有“白矾多人药用”。白矾[KAl(SO4)2·12H2O]又称明矾.钾铝矾、钾明矾等,是一种重要的化学试剂。下列说法正确的是( )
A.含白矾的药物不宜与胃药奧美拉唑碳酸氢钠胶囊同时服用
B.0.1molL-1白矾溶液完全水解生成Al(OH)3胶粒数小于6.02×1022
C.向含0.1mol白矾的溶液中滴入Ba(OH)2溶液,若SO42-和Al3+全部转化为BaSO4和Al(OH)3沉淀,则此时生成沉淀的质量最大
D.室温下,0.1molL-1白矾溶液中水电离出c(H+)小于10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下表中的四个热化学方程式,判断氢气和丙烷的标准燃烧热分别是
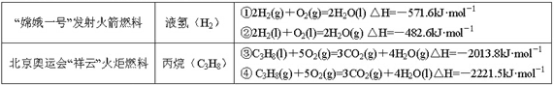
A.-571.6 kJ·mol-1,-2221.5 kJ·mol-1B.-285.5 kJ·mol-1,-2013.8 kJ·mol-1
C.-285.8 kJ·mol-1,-2221.5 kJ·mol-1D.-241.3 kJ·mol-1,-2013.8 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com