
【题目】2.7g铝粉分别与体积均为100mL、浓度均为1.5mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室通过6NaClO3 + CH3OH + 3H2SO4 = 6ClO2 + 5H2O + 3Na2SO4 + CO2制备ClO2,并将其转化为便于运输和储存的NaClO2固体,实验装置如图所示。(已知ClO2沸点为10℃,浓度较高时易发生爆炸)下列说法正确的是
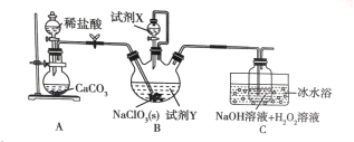
A.试剂X是甲醇
B.B中开始反应后立即停止通二氧化碳
C.此实验可以不用冰水浴
D.C中发生的反应方程式为:2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两U形管各盛有100mL溶液,请回答下列问题:
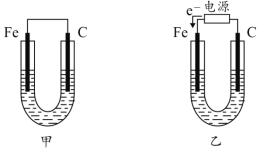
(1)若两池中均为饱和NaCl溶液:
①甲池中铁电极发生_____________腐蚀(填“析氢”或“吸氧”),碳棒上电极反应式__________________________;
②甲池铁棒腐蚀的速率比乙池铁棒_____(填“快”、“慢”或“相等”)。
(2)若乙池中盛CuSO4溶液:
①电解硫酸铜溶液的化学方程式___________________________________;
②乙池反应一段时间后,两极都产生3.36L(标况)气体,该硫酸铜溶液的浓度为___________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近采用碳基电极材料设计了一种新的工艺方案消除甲醇对水质造成的污染,主要包括电化学过程和化学过程,原理如图所示,下列说法错误的是
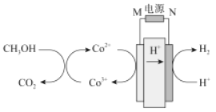
A.M为电源的正极,N为电源负极
B.电解过程中,需要不断的向溶液中补充Co2+
C.CH3OH在溶液中发生6Co3++CH3OH+H2O===6Co2++CO2↑+6H+
D.若外电路中转移1mol电子,则产生的H2在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L恒容密闭容器中,发生反应2NO(g)+O2(g)![]() 2NO2(g)。
2NO2(g)。
(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
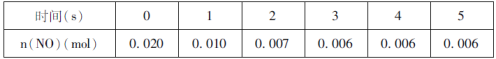
以O2浓度变化表示的反应速率,0~4s内的________(填“小于”、“大于”或“等于”)1~5s内的。
(2)该反应的平衡常数表达式为K=________,能说明该反应已达到平衡状态的是________。
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.v逆(NO)=2v正(O2) D.气体密度保持不变
(3)已知:K(300℃)>K(400℃)。下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是________。
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.用排饱和食盐水的方法收集氯气
B.钢铁在潮湿的空气中比在干燥的空气中容易生锈
C.温度过高对合成氨不利
D.常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是黑棕色晶体,沸点为315℃,有强烈的吸水性,易潮解。某小组同学对无水FeCl3能否分解产生Cl2,进行了如下实验探究。
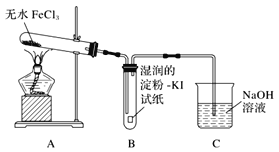
(1)甲同学认为装置B中湿润的淀粉KI试纸变蓝即可证明无水FeCl3能分解产生Cl2,乙同学认为不能得出此结论,理由是_______。
(2)乙同学提出了改进意见,用如图所示装置进行实验:
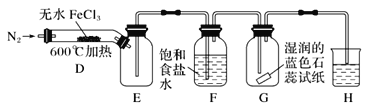
装置H中的试剂为________。装置F中饱和食盐水的作用是________。实验结束后,取装置D中残留固体溶于稀盐酸中,向所得溶液中加入_________(填化学式)溶液,若观察到_____,说明FeCl3已经分解完全。
(3)实验后把镁条投入装置F的溶液中,发生的现象是___,其原因是(结合离子方程式)解释_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。下列说法正确的是
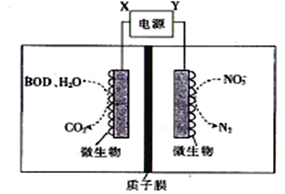
A. X为电源负极
B. 若该装置在高温下进行,则净化效率将降低
C. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
D. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极流出20 mol e-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com