
【题目】如图所示,甲、乙两U形管各盛有100mL溶液,请回答下列问题:
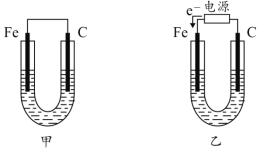
(1)若两池中均为饱和NaCl溶液:
①甲池中铁电极发生_____________腐蚀(填“析氢”或“吸氧”),碳棒上电极反应式__________________________;
②甲池铁棒腐蚀的速率比乙池铁棒_____(填“快”、“慢”或“相等”)。
(2)若乙池中盛CuSO4溶液:
①电解硫酸铜溶液的化学方程式___________________________________;
②乙池反应一段时间后,两极都产生3.36L(标况)气体,该硫酸铜溶液的浓度为___________ mol·L-1。
【答案】吸氧 O2+2H2O+4e-=4OH- 快 2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑ 1.5
2Cu+2H2SO4+O2↑ 1.5
【解析】
(1)若两池中均为饱和NaCl溶液:甲池属于原电池,铁易失电子作负极,碳作负极,正极上氧气得电子发生还原反应;乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极被保护,据此分析解答;
(2)①若乙池中盛CuSO4溶液,C电极为阳极,溶液中的氢氧根离子失电子发生氧化反应,铁电极为阴极,溶液中的铜离子得电子发生还原反应,据此书写电解硫酸铜溶液的化学方程式;②两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,阴极首先是铜离子放电,铜离子反应完成后,再氢离子放电,根据得失电子守恒计算。
(1)①甲装置是将化学能转化为电能的装置,为原电池,铁易失电子作负极,碳作正极,在饱和NaCl溶液中,正极上氧气得电子发生还原反应,为吸氧腐蚀,正极反应式为2H2O+O2+4e-=4OH-,故答案为:吸氧;2H2O+O2+4e-=4OH-;
②甲装置是将化学能转化为电能的装置,为原电池,铁易失电子作负极,乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,被保护,所以甲池铁棒腐蚀的速率比乙池铁棒快,故答案为:快;
(2)①若乙池中盛CuSO4溶液,C电极为阳极,溶液中的氢氧根离子失电子发生氧化反应,铁电极为阴极,溶液中的铜离子得电子发生还原反应,则电解硫酸铜溶液的化学方程式为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H2O
2Cu+2H2SO4+O2↑,故答案为:2CuSO4+2H2O![]() 2Cu+2H2SO4+O2↑;
2Cu+2H2SO4+O2↑;
②3.36L(标况)气体的物质的量为![]() =0.15mol,两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,生成氧气0.15mol,共失电子0.15mol×4=0.6mol;阴极首先是铜离子放电,电极反应式为Cu2++2e-=Cu,铜离子反应完成后,氢离子再放电,电极反应式为2H++2e-=H2↑,生成氢气0.15mol,得电子0.15mol×2=0.3mol,据得失电子守恒有2n(Cu2+)+0.3=0.6,n(Cu2+)=0.15mol,所以c(Cu2+)=
=0.15mol,两极都产生3.36L(标况)气体,则阳极上始终是氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,生成氧气0.15mol,共失电子0.15mol×4=0.6mol;阴极首先是铜离子放电,电极反应式为Cu2++2e-=Cu,铜离子反应完成后,氢离子再放电,电极反应式为2H++2e-=H2↑,生成氢气0.15mol,得电子0.15mol×2=0.3mol,据得失电子守恒有2n(Cu2+)+0.3=0.6,n(Cu2+)=0.15mol,所以c(Cu2+)=![]() =1.5mol/L,故答案为:1.5。
=1.5mol/L,故答案为:1.5。


 核心素养学练评系列答案
核心素养学练评系列答案科目:高中化学 来源: 题型:
【题目】(1)比较结合 H+能力的相对强弱:H2O_____NH3 (填“>”、“<”或“=”);用一个离子 方程式说明 H3O+和 NH4+给出 H+能力的相对强弱_____。
(2)NaOCN 是离子化合物,各原子均满足 8 电子稳定结构。写出 NaOCN 的电子式_____。
(3)乙酸汽化时,测定气体的相对分子质量,有数据表明其摩尔质量变为 120g·mol-1,从结构上 分析其可能的原因是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是()
A.相同物质的量浓度的CH3COOH和CH3COONa溶液中的c(CH3COO-)
B.相同质量的钠分别完全转化为Na2O和Na2O2时转移的电子数
C.相同物质的量的丙烷和2-甲基丙烷中所含C-H键的数目
D.标准状况下,相同体积的乙炔和苯中所含的H原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCl(g)分别在有、无催化剂的条件下分解的能量变化如图所示,下列说法正确的是
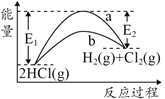
化学键 | H—H | H—Cl | Cl—Cl |
键能kJ·mol-1 | 436 | 431 | 243 |
A.由键能可得1molHCl(g)完全分解需吸收183kJ的能量
B.有催化剂的反应曲线是a曲线
C.a曲线变为b曲线,反应物的活化分子百分数增大
D.b曲线的热化学方程式为:2HCl(g)=H2(g)+Cl2(g) ΔH=-( E1-E2 )kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(OH)能氧化降解有机污染物。下列说法错误的是
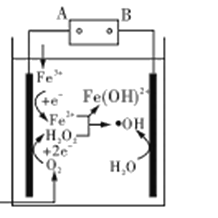
A.电源的A极为负极
B.每消耗2. 24 LO2(标准状况),整个电解池中理论上可产生的OH为0.2 mol
C.与电源B极相连电极的电极反应式为:H2O-e-=H++﹒OH
D.H2O2与Fe2+发生的反应方程式为:H2O2+Fe2+=Fe(OH)2++﹒OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X是药物的中间体,它的一种合成路线如下。
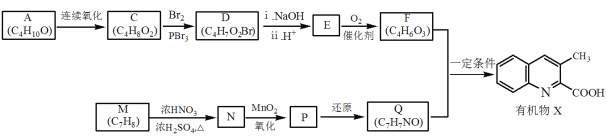
已知:RNH2+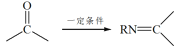 +H2O
+H2O
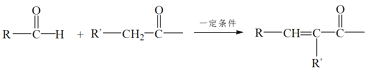
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 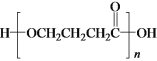
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
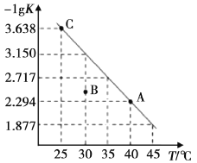
A.C点对应状态的平衡常数K(C)=10-3.638
B.该反应的ΔH>0
C.NH3的体积分数不变时,该反应一定达到平衡状态
D.30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.7g铝粉分别与体积均为100mL、浓度均为1.5mol/L的①硫酸溶液、②烧碱溶液、③盐酸完全反应,放出氢气的体积(相同条件)是
A.①=②=③B.①=②>③C.①>②>③D.②>①=③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸阿比朵尔,适合治疗由 A、B 型流感病毒引起的上呼吸道感染,2020 年入选新冠肺炎试用药物,其合成路线:
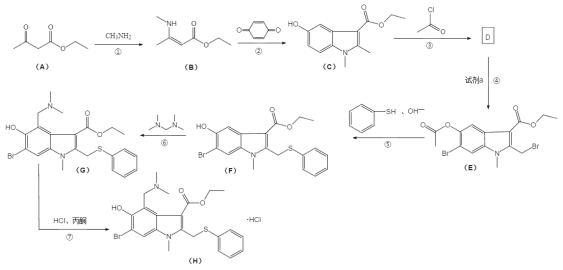
回答下列问题:
(1)有机物 A 中的官能团名称是______________和______________。
(2)反应③的化学方程式______________。
(3)反应④所需的试剂是______________。
(4)反应⑤和⑥的反应类型分别是______________、______________。
(5)I 是 B 的同分异构体,具有两性并能与碳酸氢钠溶液反应放出气体,写出具有六元 环结构的有机物 H 的结构简式______________。 (不考虑立体异构,只需写出 3 个)
(6)已知:两分子酯在碱的作用下失去一分子醇生成β—羟基酯的反应称为酯缩合反应,也称为 Claisen (克莱森)缩合反应,如: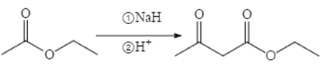 ,设计由乙醇和
,设计由乙醇和![]() 制备
制备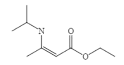 的合成线路______________。(无机试剂任选)
的合成线路______________。(无机试剂任选)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com