
【题目】在标准状况下![]()
![]()
![]() 个HCl分子
个HCl分子 ![]()
![]()
![]()
![]() ,下列对这四种气体的关系从大到小表达正确的是( )
,下列对这四种气体的关系从大到小表达正确的是( )
![]() 体积
体积![]() 密度
密度![]()
![]() 电子总数
电子总数![]() 原子总数
原子总数![]()
A. abcdB. bcdC. acdD. abc
【答案】A
【解析】
①标准状况下6.72LCH4的物质的量n(CH4)=6.72L÷22.4L/mol=0.3mol;
②3.01×1023个HCl分子的物质的量为n(HCl)= (3.01×1023)÷(6.02×1023/mol)=0.5mol;
③17.6gCO2气体的物质的量为n(CO2)=17.6g÷44g/mol=0.4mol;
④0.2,molNH3;
![]() 根据V=n·Vm可知:相同条件下,气体的体积之比等于物质的量之比,所以体积体积
根据V=n·Vm可知:相同条件下,气体的体积之比等于物质的量之比,所以体积体积![]() ,a正确;
,a正确;
![]() 气体密度ρ=
气体密度ρ=![]() 可知:各物质的摩尔质量分别为①CH4为16g/mol;②HCl为36.5g/mol;③CO2为44g/mol;④NH3为17g/mol。相同条件下,密度之比等于摩尔质量之比,所以密度:
可知:各物质的摩尔质量分别为①CH4为16g/mol;②HCl为36.5g/mol;③CO2为44g/mol;④NH3为17g/mol。相同条件下,密度之比等于摩尔质量之比,所以密度:![]() ,b正确;
,b正确;
![]() 根据N=n·NA知,分子数与物质的量成正比,所以分子总数
根据N=n·NA知,分子数与物质的量成正比,所以分子总数![]() ,甲烷分子中含有10个电子,HCl中含有18个电子,CO2分子中含有22个电子,NH3分子中含有10个电子,所以电子的物质的量分别是3mol、9mol、
,甲烷分子中含有10个电子,HCl中含有18个电子,CO2分子中含有22个电子,NH3分子中含有10个电子,所以电子的物质的量分别是3mol、9mol、![]() 、2mol,故电子总数
、2mol,故电子总数![]() ,c正确;
,c正确;
![]() 根据N=n·NA可知:分子数与物质的量成正比,所以分子总数
根据N=n·NA可知:分子数与物质的量成正比,所以分子总数![]() 。甲烷分子中含有5个原子、HCl分子中含有2个原子、
。甲烷分子中含有5个原子、HCl分子中含有2个原子、![]() 分子中含有3个原子、氨气分子中含有4个原子,所以原子的物质的量分别为1.5mol,1mol、1.2mol、0.8mol,所以原子总数
分子中含有3个原子、氨气分子中含有4个原子,所以原子的物质的量分别为1.5mol,1mol、1.2mol、0.8mol,所以原子总数![]() ,d正确;
,d正确;
故合理选项是A。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】某二次电池放电时的化学方程式为:2K2S2+KI3=K2S4+3KI.与其它设备连接的电路如图示.当闭合开关K时,X附近溶液先变红.则下列说法正确的是( )

A. K+从右到左通过离子交换膜
B. A的电极反应式为:3I﹣﹣2e﹣=I3﹣
C. 当有0.1 mol K+通过离子交换膜,X电极上产生标准状况的气体1.12 L
D. 电池充电时,B电极要与外电源的正极相连,电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质所处的类别,以及是否具有氧化性或还原性能帮助我们认识其化学性质。
(1)请从下列试剂中选择合适的完成指定转化(试剂可以重复选择)。
试剂:盐酸、NaOH溶液、NaCl溶液、Na2SO4溶液、稀硝酸、FeSO4溶液
①P2O5(一种酸性氧化物)→Na3PO4的离子方程式:___;
②SO2→H2SO4的离子方程式:___;
③(NH4)2CO3→Na2CO3的离子方程式:___。
(2)根据如图所示物质的转化信息书写相应的反应方程式。
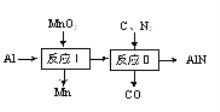
①“反应Ⅰ”的条件是高温,写出该反应的化学方程式:___;
②“反应Ⅱ”的条件是1700℃,写出该反应的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
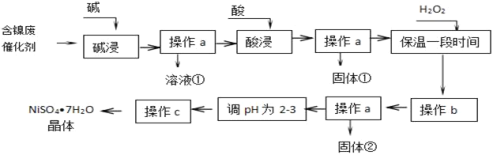
【题目】镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
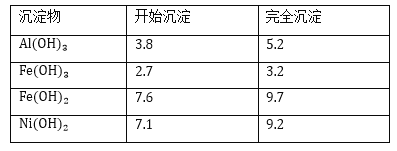
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
(1)溶液①中含金属元素的离子是_________;
(2)用离子方程式表示加入双氧水的目的______________;双氧水可以用下列物质替代的是_________
A.氧气 ![]() 漂白液
漂白液 ![]() 氯气
氯气 ![]() 硝酸;
硝酸;
(3)操作b调节溶液pH范围为______________;
(4)操作a和c需要共同的玻璃仪器是_______;上述流程中,防止浓缩结晶过程中,Ni2+水解的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关说法正确的是
A. 60g冰醋酸晶体中,含阴离子数目为NA
B. 标准状况下,22.4LCCl4中含有分子的数目为NA
C. 常温下,46gNO2与N2O4混合气体中含分子数为NA
D. 32gCu投入300mL10mol/L的浓硝酸中,充分反应后转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式:________。
(2)根据等电子原理,写出CO分子的结构式__________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醛分子中碳原子轨道的杂化类型为_______________。
②甲醛分子的空间构型是___________;1 mol甲醛分子中σ键的数目为______________。
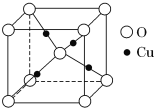
③在1个Cu2O晶胞(结构如图所示)中,所包含的Cu原子数目为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示:下列说法不正确的是
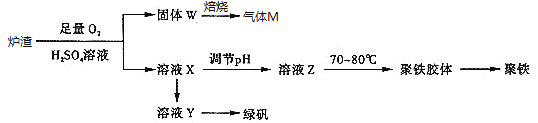
A. 炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+=4Fe3++4S↓+6H2O
B. 气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C. 向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再经蒸发浓缩、冷却结晶、过滤等步骤得到绿矾
D. 溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式是A+B![]() X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
(1)若Y是黄绿色气体,则Y的电子式是______,该反应的离子方程式是______。
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①元素在周期表中的位置是______(填所在周期和族);Y的化学式是______。
②含amolX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是______mol。
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g)![]() 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A. 以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B. 其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C. 其他条件不变,若增大压强,则物质A的转化率减小
D. 达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com