
现有室温下浓度均为1×10-3mol/L的几种溶液:
①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ________ ⑥(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH ________ 7(填“>”、“<”或“=”)
用离子方程式说明其原因 _______________________
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的为________ (填写序号)
最终产生H2总量的关系为___________(填写序号)
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① _________ ③(填“>”、“<”或“=”)
(5)将等体积的⑤、⑥溶液加热至同温度后,溶液的pH ⑤ _____ ⑥(填“>”、“<”或“=”)
(1)> ;c(Na+)="c" (CH3COO-)> c(H+)="c" c(OH-).
(2)< NH4++H2O NH3·H2O+H+ (3)②>①>③; ②>①=③ ;(4)< (5)<
NH3·H2O+H+ (3)②>①>③; ②>①=③ ;(4)< (5)<
解析试题分析:(1)由于醋酸是弱酸,NaOH是强碱,所以将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③>⑥; 根据电荷守恒可得:c(Na+)+c(H+)="c" (CH3COO-)+c(OH-),由于溶液呈中性, c(H+)="c" c(OH-),所以c(Na+)="c" (CH3COO-),在盐溶液中盐电离远大于弱电解质水的电离作用,所以c(Na+)="c" (CH3COO-)> c(H+)="c" c(OH-);(2)由于HCl是强酸,NH3·H2O是弱碱,所以将等体积的①、⑤混合,则恰好完全发生产生盐NH4Cl,该盐是强酸弱碱盐,NH4+水解消耗水电离产生的OH-,最终使溶液中的H+的浓度大于OH-,所以溶液显酸性,pH<7,水解的离子方程式是NH4++H2O NH3·H2O+H+;(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,由于溶液中c(H+)关系是:②>①>③,所以反应的初始速率由快到慢的为②>①>③,因为硫酸是二元酸,而盐酸和醋酸是一元酸,所以最终产生H2总量的关系为②>①=③ ;(4)盐酸是强酸,完全电离,而醋酸是弱酸,部分电离,在溶液中存在电离平衡,当向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,由于会对醋酸的电离平衡起抑制作用,所以醋酸的酸性比原来还小,混合液的pH 大小关系为①<③; (5)NH3·H2O是弱碱,部分电离,而NaOH是强碱,完全电离,所以溶液中离子的浓度NaOH>NH3·H2O故溶液的pH ⑤ <⑥。
NH3·H2O+H+;(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,由于溶液中c(H+)关系是:②>①>③,所以反应的初始速率由快到慢的为②>①>③,因为硫酸是二元酸,而盐酸和醋酸是一元酸,所以最终产生H2总量的关系为②>①=③ ;(4)盐酸是强酸,完全电离,而醋酸是弱酸,部分电离,在溶液中存在电离平衡,当向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,由于会对醋酸的电离平衡起抑制作用,所以醋酸的酸性比原来还小,混合液的pH 大小关系为①<③; (5)NH3·H2O是弱碱,部分电离,而NaOH是强碱,完全电离,所以溶液中离子的浓度NaOH>NH3·H2O故溶液的pH ⑤ <⑥。
考点:考查溶液中两种浓度的大小比较、还小反应速率的计算、溶液的酸碱性的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是
| A.AgCl不溶于水,不能转化为AgI |
| B.两种难溶物的Ksp相差越大,难溶物就越容易转化为更难溶的难溶物 |
| C.AgI比AgCl更难溶于水,所以AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于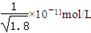 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,下列各组比值为1∶2的是
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下
实验。请你完成下列填空:
步骤一:配制100mL 0.10mol/L NaOH标准溶液。.
步骤二:取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,消耗NaOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.02 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 21.98 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-)填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
写出碳酸的第一级电离平衡常数表达式:Ki = _ __
在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性最强的是
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A. c(CH3COO-) B. c(H+) C. w醋酸电离平衡常数 D. 醋酸的电离度  (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。
下列叙述不正确的是  w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列(填序号)。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 | 9.6 |
| 完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com