
【题目】α-鸢尾酮香料的分子结构如图,下列说法不正确的是

A. α-鸢尾酮可与某种酚互为同分异构体
B. 1 mol α-鸢尾酮最多可与3molH2加成
C. α-鸢尾酮能发生银镜反应
D. α-鸢尾酮经加氢→消去→加氢三步反应可转变为![]()
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
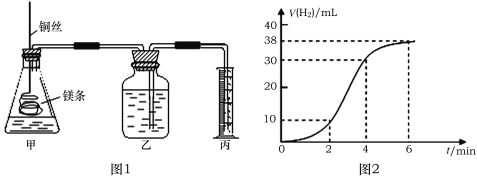
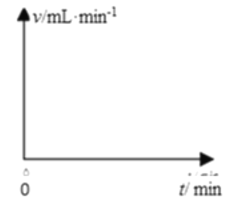
(1)请在图中画出上述反应中H2的速率与时间的关系曲线______________。
(2)在前4 min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2= -574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3= -1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是________ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2xCO(g)N2(g)+2xCO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
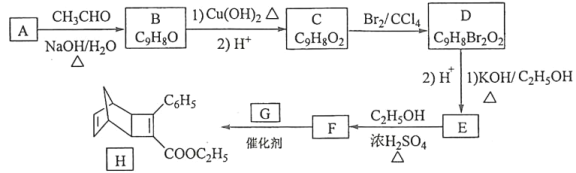
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:
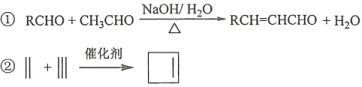
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物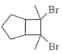 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用KMnO4和浓盐酸反应制取氯气:KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
(1)配平化学方程式,并用单线桥标出电子转移的方向和数目。________。
(2)将上述配平的化学方程式改写为离子方程式________。
(3)浓盐酸在反应中显示出来的性质是________。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若产生0.5mol Cl2,则被氧化的HCl ____mol,转移的电子的数目约为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)经计算需要________mL浓盐酸。
(2)在配制稀盐酸溶液时,选用的仪器除了玻璃棒、烧杯、胶头滴管、还有______________。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面最低处与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)___________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
![]()
A.原子半径Q>R>T
B.原子序数比R多1的元素只能形成一种氢化物
C.W原子得电子能力强于Q原子,且可形成共价化合物QW2
D.与W同一主族的下一周期元素不可作为半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要480mL1mol·L-1NaOH溶液,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平(砝码)、药匙、量筒、烧杯、玻璃棒外还需要的其他仪器有___。
(2)如图是某同学在实验室配制该NaOH溶液的过程示意图,其中有错误的是___(填操作序号)。
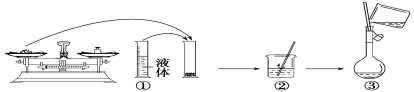
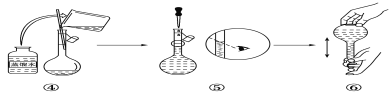
(3)下列操作会导致所配溶液的物质的量浓度偏高的是___。
A.配制NaOH溶液时,NaOH固体中含有Na2O杂质
B.用蒸馏水溶解NaOH固体后,立即转入容量瓶中定容
C.定容后发现液面高于刻线,可用胶头滴管将多余的水吸出
D.定容时仰视刻度线
E.用托盘天平称量 NaOH 固体时,砝码生锈
F.配制前容量瓶中有少量蒸馏水
(4)若某同学用密度为1.2g/cm3,质量分数为36.5%的浓盐酸配制100mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为___mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
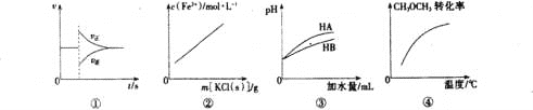
A. 图①可表示反N2(g)+3H2(g) ![]() 2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
2NH3(g)在达到平衡后,臧少NH3的浓度,正逆反应速率的变化趋势
B. 图②表示FeCl3溶液和KSCN溶液反应达平衡后,向该混合液中逐渐加人固体KCl的过程中C(Fe3+)的变化趋势(忽略溶液体积变化)
C. 图③表示等体积等pH的弱酸HA和强酸HB加水稀释过程中的pH变化趋势
D. 图④表示密闭容器中CH3OCH3(g)+3H2O(g) ![]() 6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
6H2(g)+2CO2(g) △H>0达到平衡后,恒压升高温度过程中,CH3OCH3的转化率变化趋势
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com