
| A、2种 | B、4种 | C、6种 | D、5种 |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、加入适量NaCl溶液 |
| B、加入适量NaOH溶液 |
| C、加入数滴CuCl2溶液 |
| D、加入适量NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸保存在棕色玻璃试剂瓶中 |
| B、少量的金属锂保存在煤油中 |
| C、氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 |
| D、少量液溴通常保存在棕色玻璃试剂瓶中,并在液溴上加少量水液封 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.56mol/L |
| B、4.36mol/L |
| C、5.00mol/L |
| D、5.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、简单离子半径大小顺序:r(T)<r(X)<r(Y) |
| B、T与Z的最高正化合价相等 |
| C、室温下,单质Y不能与浓硫酸反应 |
| D、可用电解法制得X、Y、Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
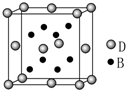 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.查看答案和解析>>
科目:高中化学 来源: 题型:
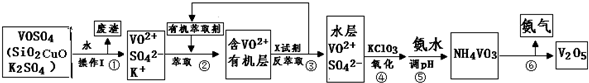
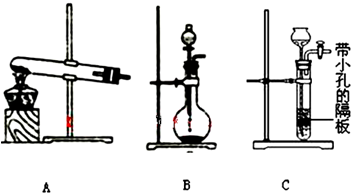
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② |
浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com