
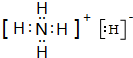 ,
,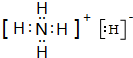 ;
;
| ||
| ||
| KW |
| Ka2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
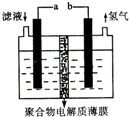 将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )
将H2S通人FeCl3溶液中,过滤后将反应液加人电解槽中电解(如图所示)电解后的溶液还可以循环利用.该方法可用于处理石油炼制过程中产生的H2S废气.下列有关说法正确的是( )| A、过滤得到的沉淀可能是FeS和S |
| B、若有0.20mol的电子转移,一定能得到2.24L的氢气 |
| C、可以用Fe与外接电源的a极相连 |
| D、与a极相连的电极反应为Fe2+-e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:


 ,标明每一部的反应物及反应条件(有机物写结构简式,其他原料自选 )
,标明每一部的反应物及反应条件(有机物写结构简式,其他原料自选 )查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
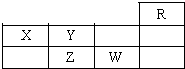
| A、常压下五种元素的单质中W单质的沸点最高 |
| B、Z的氢化物比Y的氢化物稳定 |
| C、W元素最高价氧化物的水化物酸性比Z元素的强 |
| D、Z、W的阴离子电子层结构与R原子的相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com