
科目:高中化学 来源:不详 题型:填空题
 1/2N2O4(g) △H =-26.35 kJ·mol-1
1/2N2O4(g) △H =-26.35 kJ·mol-1 2NH3(g) △H<0的影响如图所示。
2NH3(g) △H<0的影响如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
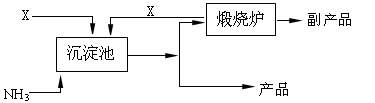
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
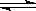 2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +SO2
+SO2 +H2O下列各组实验中溶液最先变浑浊的是
+H2O下列各组实验中溶液最先变浑浊的是 | 组号 | | 参加反应的物质 | ||||
| 反应温度(℃) | 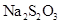 |  |  | |||
| V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | ||
| A | 10 | 5 | 0.1 | 5 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.2 | 5 | 0.2 | 5 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该反应熵值增大,故能自发进行 |
| B.高温下能自发进行 |
| C.低温下不能自发变化,高温下能自发变化 |
| D.任何温度下都不能自发变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com