
【题目】在某钠盐溶液中,除![]() 之外可能还含有等物质的量的下列阴离子中的一种或多种:
之外可能还含有等物质的量的下列阴离子中的一种或多种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。关于此溶液,下列说法正确的是
。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。关于此溶液,下列说法正确的是![]()
A.原溶液中可能含有![]()
B.生成的气体中一定有NO,可能含有![]()
C.溶液中减少的离子是![]() 、
、![]() 、
、![]()
D.原溶液中一定含有![]()
科目:高中化学 来源: 题型:
【题目】Ⅰ.测定![]() 样品的纯度可用标准
样品的纯度可用标准![]() 溶液进行滴定,取
溶液进行滴定,取![]() 样品溶解酸化后,用
样品溶解酸化后,用![]() 标准
标准![]() 溶液进行滴定,标准
溶液进行滴定,标准![]() 溶液应盛装在________
溶液应盛装在________![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中。实验中,滴定至终点时消耗
滴定管中。实验中,滴定至终点时消耗![]() 溶液
溶液![]() ,则该样品中
,则该样品中![]() 的质量分数是________。
的质量分数是________。![]() 有关离子方程式为:
有关离子方程式为:![]()
Ⅱ.铁矿石中含铁量的测定

(1)步骤![]() 中煮沸的作用是________。
中煮沸的作用是________。
(2)步骤![]() 中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(3)下列有关步骤![]() 的操作中说法正确的是________。
的操作中说法正确的是________。
![]() 因为碘水为黄色,所以滴定过程中不需加指示剂
因为碘水为黄色,所以滴定过程中不需加指示剂
![]() 滴定过程中可利用淀粉溶液作为指示剂
滴定过程中可利用淀粉溶液作为指示剂
![]() 滴定管用蒸馏水洗涤后可以直接装液
滴定管用蒸馏水洗涤后可以直接装液
![]() 锥形瓶不需要用待测液润洗
锥形瓶不需要用待测液润洗
![]() 滴定过程中,眼睛注视滴定管中液面变化
滴定过程中,眼睛注视滴定管中液面变化
![]() 滴定结束后,
滴定结束后,![]() 内溶液不恢复原来的颜色,再读数
内溶液不恢复原来的颜色,再读数
Ⅲ.一些食品添加剂、抗氧化剂中含有焦亚硫酸钠![]() ,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:
,大量的焦亚硫酸钠会损伤细胞,具有生物毒性。已知:![]() 溶于水会生成
溶于水会生成![]() 。检验
。检验![]() 晶体在空气中已被氧化的实验方法是________。
晶体在空气中已被氧化的实验方法是________。
Ⅳ![]() 某化学兴趣小组用铜和浓硫酸制取
某化学兴趣小组用铜和浓硫酸制取![]() ,并依次检验
,并依次检验![]() 具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示
具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示![]() 图中连接胶管、夹持和加热装置省略
图中连接胶管、夹持和加热装置省略![]() :
:
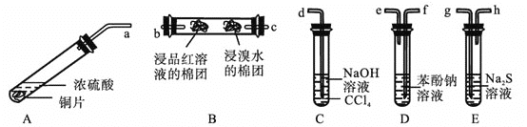
查阅资料可知:![]() 的酸性强弱与
的酸性强弱与![]() 相近。
相近。
上述装置的接口连接顺序依次是![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() 填导管接口字母
填导管接口字母![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
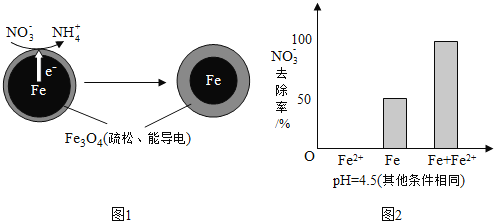
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,水的离子积常数KW=1.0×10-12,请回答下列问题:
(1)此温度___25℃(填“>”、“<”或“=”),原因是___。
(2)对水进行下列操作,能抑制水的电离的是___。
A.通入适量SO2气体 B.加入适量Ba(OH)2溶液
C.升温至60℃ D.加入NH4Cl溶液
(3)此温度下纯水中的c(H+)=__。
(4)醋酸的下列性质中,可以证明它是弱电解质的是___。
①1mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1
②CH3COOH可以任意比与H2O互溶
③在相同条件下,CH3COOH溶液的导电性比盐酸弱
④10mL1mol/L的CH3COOH恰好与10mL1mol/L的NaOH溶液完全反应
⑤同浓度同体积的醋酸和盐酸与Fe反应时,醋酸溶液中放出H2的速度慢
⑥醋酸溶液中CH3COOH、CH3COO-、H+同时存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 某地区的雾霾中可能含有如下可溶性离子:
某地区的雾霾中可能含有如下可溶性离子:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成如下实验:
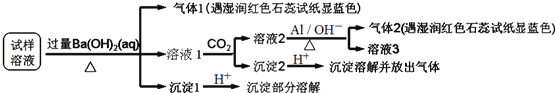
根据以上的实验操作与现象,该同学得出的结论错误的是![]()
A.试样中肯定存在![]() 、
、![]() 和
和![]() ,可能有
,可能有![]()
B.试样中不一定存在![]() 、
、![]() 、
、![]()
C.沉淀2中可能含碳酸钡、碳酸镁和氢氧化铝
D.该雾霾中可能存在![]() 、
、![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解精炼铜的阳极泥是重要的二次资源,从阳极泥(含铜、银、金、铅等单质)中提取金和制备AgCl的工艺如下:

已知:分金液的主要成分为H[AuCl4];分金渣的主要成分为PbSO4和AgCl;分银液的主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3-![]() Ag++2SO32-
Ag++2SO32-
回答下列问题:
(1)“分铜”时,铜单质参与反应的离子方程式为___________;如果温度过高,铜的浸出率会降低,原因是____________。
(2)“分铜渣”中的成分有Au、Ag、AgCl和__________。
(3)“分金”时,溶解单质金的化学方程式为________;除HC1、NaC1O3可溶解金外,“王水”也可溶解金,“王水”的成分为_____________(写试剂的名称)。
(4)从“分金液”中提取金时,氧化剂和还原剂的物质的量之比为_______________。
(5)向“分银液”中加入适量的H2SO4调到pH=4时“沉银”,能够析出AgCl的原因是___________。
(6)AgCl能溶于氨水,发生反应AgCl(s)+2NH3(aq)![]() [Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知
[Ag(NH3)2](aq))+Cl-(aq),其平衡常数K=2.0×10-3,现用1L某浓度氨水(溶质视为NH3)完全溶解0.1mol AgCl,所需氨水浓度至少为____________mol·L-1(已知![]() =2.25)。
=2.25)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5:M=190 g·mol-1)在食品加工中常用作防腐剂、漂白剂和疏松剂。焦亚硫酸钠为黄色结晶粉末,150℃时开始分解,在水溶液或含有结晶水时更易被空气氧化。焦亚硫酸钠(Na2S2O5)在实验室可用如图装置制备。
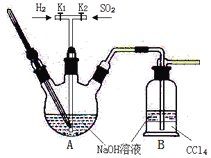
已知:2NaHSO3![]() Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
Na2S2O5+H2O S2O52-+2H+=2SO2↑+H2O
(1)实验中如果SO2通入过多,会降低Na2S2O5的产率,试解释其原因__________。
(2)测定产品中焦亚硫酸钠的质量分数常用剩余碘量法(杂质不与碘反应)。
已知:S2O52-+2I2+3H2O=2SO42-+4I-+6H+; 2S2O32-+I2 =S4O62-+2I-
称取0.2000 g产品放入碘量瓶中,加入40.00 mL 0.1000 mol·L-1的标准碘溶液,在暗处放置5 min,再加入适量冰醋酸及蒸馏水。用0.2000 mol·L-1的标准Na2S2O3溶液滴定剩余的碘至终点,重复操作3次,测得平均消耗标准Na2S2O3溶液20.00 mL。则产品中焦亚硫酸钠的质量分数为__________________。
(3)关于本实验的说法错误的是_________。
A.B装置中CCl4的作用是防止倒吸
B.滴定时,Na2S2O3溶液应该用碱式滴定管盛放
C.滴定终点的现象是刚好变蓝色
D.滴定时间过长会导致测得产品中焦亚硫酸钠的质量分数偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
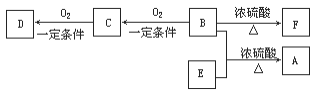
已知:
ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。
ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。
ⅳ.F可以使溴的四氯化碳溶液褪色。
(1)B可以发生的反应有_______(选填序号)。
a.取代反应 b.加聚反应 c.消去反应 d.氧化反应
(2)D、F分子所含的官能团的结构简式依次是_______、________。
(3)写出与D、E具有相同官能团的一种同分异构体的结构简式___________。
(4)写出B和E反应生成A的化学方程式是_______________。
(5)写出C与新制Cu(OH)2反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
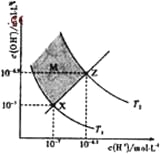
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com