
【题目】在Cu与浓硝酸反应中,若有1molHNO3 被还原,则发生转移的电子是( )
A. 1mol B. 2mol C. 0.5mol D. 0.25mol
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】已知某元素原子的L电子层上有6个电子,则该元素在周期表中位于( )
A. 第3周期IVA族 B. 第2周期VIA族
C. 第2周期IVA族 D. 第3周期VIA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为________ mol·L1(计算结果保留 2位有效数字)。
(2)某同学取 100mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中 c(Na+)=_______ mol·L1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制 480mL含NaClO质量分数为25%的消毒液。下列说法正确的是______(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B. 将称量好的NaClO固体在烧杯中溶解后应立即转入容量瓶并加水至刻度线
C. 定容时俯视容量瓶刻度线会导致所配溶液浓度偏高
D.需要称量 NaClO固体的质量为 143.0g

(4)该同学对容量瓶及其使用方法的认识中正确的是________
A.容量瓶上标有容积、温度和浓度
B.容量瓶用蒸馏水洗净后, 需要烘干后再使用
C.配制溶液过程中,容量瓶内液体只需要一次摇匀过程
D.使用前要检查容量瓶是否漏水
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 98%(密度为1.84g·cm3)的浓硫酸配制 2L 2.3mol·L1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为_______ mol·L1。
②需用浓硫酸的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. 可用电渗析法进行海水淡化
B. 乙烯与氧气在银催化作用下只生成环氧乙烷(![]() ),该反应符合绿色化学原子经济性要求
),该反应符合绿色化学原子经济性要求
C. 向某溶液中滴入盐酸酸化的氯化钡溶液出现白色沉淀,证明该溶液中一定含有SO42-
D. 酒是陈的香,原因之一是储存过程中生成了有香味的酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一-有机化学基础]在碱的作用下,两分子酯缩合形成β一羰基酯,同时失去一分子醇,该反应称克莱(R·L·Claisen)酯缩合反应,其反应机理如下: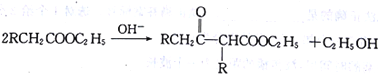 。利用Claisen反应制备化合物H的一种合成路线如下:
。利用Claisen反应制备化合物H的一种合成路线如下:
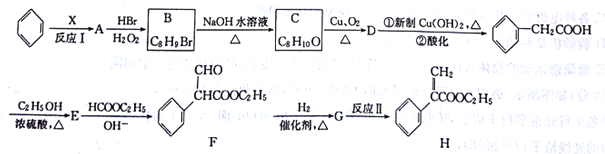
回答下列问题:
(1)反应Ⅰ的反应物和生成物的实验式均相同,则X的结构简式为_____,A的名称为____。
(2)F中含氟官能团的名称是_______;反应Ⅱ的反应类型是________。
(3)E![]() F反应的化学方程式为________。
F反应的化学方程式为________。
(4)B的含有苯环的同分异构体有____种(B自身除外),其中核磁共振氢谱显示3组峰的结构简式为__________、_________。
(5)乙酰乙酸乙酯是一种重要的有机合成原料,写出由乙醇制备乙酰乙酸乙酯的合成路线___________(无机试剂任进)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知pOH=-lgc(OH)。t℃时,往50mL0.1mol/LMOH溶液滴加0.1mol/L盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
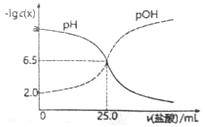
A. a=12
B. 盐酸与MOH溶液恰好中和时溶液pH=6.5
C. 滴人盐酸体积达26.0mL时,溶液中微粒浓度c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
D. t℃时,MOH的Kb>1.0×10-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请根据原电池原理回答问题:
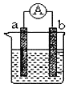
(1)若电极a为Zn、电极b为Cu、电解质溶液为稀硫酸,该装置工作时,SO42向_____极(填a或b)移动,正极的电极反应式为_______________________________。
(2)若电极a为Mg、电极b为Al、电解质溶液为氢氧化钠溶液,该原电池工作时,电子从_____极(填a或b)流出。一段时间后,若反应转移3NA个电子,则理论上消耗Al的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体的组成可表示为H2C2O4·xH2O,某研究性学习小组用下图装置进行“草酸晶体受热分解的部分产物的验证”的实验。请回答下列问题。

【资料查阅】
①草酸晶体在101 ℃时开始熔化,150 ℃时开始升华,175 ℃时开始分解;
②草酸钙和草酸氢钙均为白色不溶物。
(1)按照如图所示的装置,通过实验检验草酸晶体的部分分解产物,装置B中可观察到有气泡冒出且澄清石灰水变浑浊,由此甲同学判断草酸晶体分解的产物中有CO2。但立即遭到乙同学反对,其反对的理由可能是______________________________________。
(2)丙同学认为草酸晶体分解的产物中含有CO,为进行验证,X应选用________(填化学式)浓溶液,装置D的作用是____________________。
(3)实验过程中涉及如下操作:①点燃装置A处的酒精灯;②熄灭装置A处的酒精灯;③点燃装置E处的酒精灯;④熄灭装置E处的酒精灯。这4步操作由先到后的顺序为____________(填序号)。点燃E处酒精灯前必须要进行的操作是______________。
(4)实验过程中发现装置E中黑色粉末变红色,装置F中有黑色固体生成,经检测装置F中的固体为金属单质,则装置F中发生反应的化学方程式为________________________________________________________________________。
(5)丁同学用滴定法测定草酸晶体中结晶水的含量,进行了下列操作:
步骤一:用分析天平称取3.15 g纯净的该草酸晶体,配制成250 mL溶液。
步骤二:用移液管移取25.00 mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化。
步骤三:取0.100 mol·L-1标准酸性KMnO4溶液,进行滴定,三次结果如下表所示:
第一次 | 第二次 | 第三次 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知滴定反应的离子方程式为:MnO![]() +H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
+H2C2O4+H+―→Mn2++CO2↑+H2O(未配平)。
①配制草酸溶液的操作步骤依次是:将晶体置于烧杯中,加水溶解,将溶液转移入________,洗涤,定容,摇匀。
②通过计算确定x=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com