
【题目】已知pOH=-lgc(OH)。t℃时,往50mL0.1mol/LMOH溶液滴加0.1mol/L盐酸,溶液pH、pOH随滴入盐酸体积的变化如下图所示,以下说法正确的是
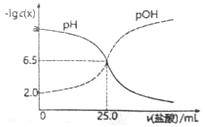
A. a=12
B. 盐酸与MOH溶液恰好中和时溶液pH=6.5
C. 滴人盐酸体积达26.0mL时,溶液中微粒浓度c(Cl-)>c(H+)>c(M+)>c(MOH)>c(OH-)
D. t℃时,MOH的Kb>1.0×10-3
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________。
②Fe的基态原子共有________种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4===2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是______________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2 nm和7.8×10-2 nm。则熔点:NiO________(填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。
该合金的晶胞结构如图所示。

①该晶体的化学式为________________。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Cu与浓硝酸反应中,若有1molHNO3 被还原,则发生转移的电子是( )
A. 1mol B. 2mol C. 0.5mol D. 0.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序不正确的是
A.热稳定性:HF>H2O>NH3B.原子半径:Cl>S>P
C.碱性:NaOH>Mg(OH)2>Al(OH)3D.金属性:K>Na>Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钒(V)及其化合物有着广泛的用途。请回答以下问题:
(1)钒在溶液中的主要聚合状态与溶液的pH关系如图1所示。V2O74-中V元素的化合价是_____,请写出溶液中VO3-转化为V2O74-的离子方程式:____________。
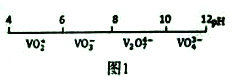
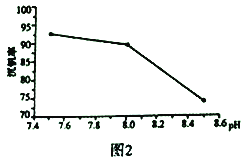
(2)“弱碱性按盐沉钒法”原理是在含有钒元素的溶液中加入铵盐后形成NH4VO3沉淀,图2是在工业生产中不同pH环境下沉钒率的测定值。实际工业生产中常选择pH=7.5为沉钒的最佳条件,当pH超过8.0时沉钒率降低,其原因是溶液中VO3-转化为V2O74-、_______。(请另写出一点原因)
(3)NH4VO3在高温下分解产生的V2O5可作为硫酸工业中2SO2(g)+O2(g)![]() 2SO3(g) △H=p的催化剂,其催化原理如图3所示。
2SO3(g) △H=p的催化剂,其催化原理如图3所示。
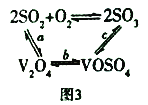
①过程a和过程b的化学方程式为:V2O5(s)+SO2(g)=V2O4(s)+SO3(g)△H=q;
V2O4(s)+O2(g)+2SO2(g)=2VOSO4(g)△H=r
请写出过程c的热化学方程式:_________________。
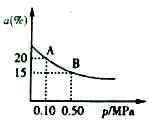
②t2℃下,反应:2SO3(g)![]() 2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
2SO2(g)+O2(g)△H>0;SO3的平衡转化率(a)与体系总压强(p)的关系如图所示。t℃下,将2molSO3置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。B点的化学平衡常数的值是__________。
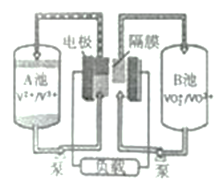
(4)全钒夜流电池是一种可充电电池,装置如图所示。若在放电过程中有H+从A池移向B池,则:
①放电过程中,起负极作用的是_______池(填“A”或“B”)。
②充电过程中,阳极方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴螨酯是一种杀螨剂。由某种苯的同系物制备溴螨酯的一种合成路线如下( 部分反应条件和试剂略):
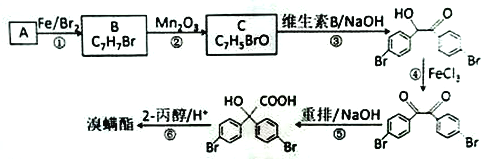
回答下列问题:
(1)A的名称是________,B 的结构简式是_______。
(2)C能发生银镜反应,其分子中含氧官能团的名称是_______。
(3)写出第3 步反应的化学方程式:________。
(4)第①、④步的反应类型分别是_______、_______。
(5)M为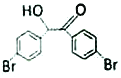 的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
的同分异构体,其核磁共振氢谱显示有4 种不同化学环境的氢,且数目比为4:4:1:1,M的结构简式为____________。
(6)写出用乙醛为原料制备2-羟基-2-甲基丙酸乙酯的合成路线( 其它试剂任选):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com