
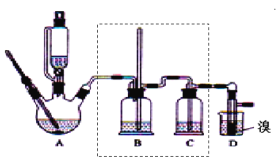
【题目】海洋植物如海带、海藻中含有丰富的碘元素,且所含碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示:

(1)指出制取碘的过程中有关实验操作的名称:①__________,②__________。
(2)操作②中可供选择的有机试剂是_________(填序号)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(3)现需做使海藻灰中的碘离子转化为有机溶液中的碘单质的实验,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、药品,尚缺少的玻璃仪器是__________、___________。
(4)要从碘的苯溶液中提取碘和回收苯,还需要经过蒸馏操作。进行蒸馏操作时,需使用水浴加热,目的是__________,最后晶态碘在________中聚集。
【答案】过滤 萃取和分液 B 普通漏斗 分液漏斗 使蒸馏烧瓶均匀受热,控制温度不过高 蒸馏烧瓶
【解析】
(1)从海藻中提取碘的流程为灼烧、浸泡、过滤、氧化、萃取分液、蒸馏;
(2)操作②为萃取,萃取剂的选择需符合与氯水互不相溶,碘的溶解度较大;
(3)使海藻灰中的碘离子转化为有机溶液中的碘单质的实验,需要的操作有浸泡、过滤、氧化、萃取分液,以此分析所需实验仪器;
(4)进行蒸馏操作时,需使用水浴加热,目的是使蒸馏烧瓶均匀受热,控制温度不过高,防止苯蒸发,最后晶态碘在蒸馏烧瓶中凝华聚集。
(1) 从海藻中提取碘的流程为灼烧、浸泡、过滤、氧化、萃取、蒸馏,由图可知操作①是过滤,操作②是萃取和分液,
故答案为:过滤;萃取和分液;
(2) 操作②为萃取,萃取剂的选择需符合与氯水互不相溶,碘的溶解度较大,由于酒精、乙酸和甘油都与水互溶,故不能用作提取碘的萃取剂,
故答案选:B。
(3)为使海藻灰中的碘离子转化为有机溶液中的碘单质,需经过溶解、过滤、氧化、萃取和分液这几个步骤。在过滤时缺少普通漏斗,在进行萃取和分液时缺少分液漏斗,
故答案为:普通漏斗;分液漏斗;
(4)苯的沸点为80.1℃。使用水浴加热的目的是使蒸馏烧瓶均匀受热,控制温度不过高(水浴加热时的温度不会超过100℃)。最后晶态碘在蒸馏烧瓶中聚集,
故答案为:使蒸馏烧瓶均匀受热,控制温度不过高;蒸馏烧瓶。


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】资料在线:查阅资料可知如表所示数据:
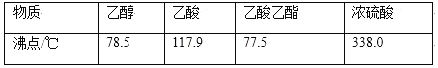
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
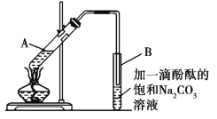
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)步骤①配制该混合溶液的主要操作步骤为___;写出制取乙酸乙酯的化学方程式:___。
(2)步骤②中需要小火均匀加热,其主要理由是________。
(3)指出步骤③所观察到的现象:________;
分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为____(填字母)。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有______。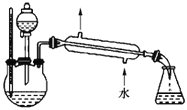
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达不正确的是( )
①丙烷的球棍模型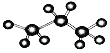 ②丙烯的结构简式为CH3CHCH2
②丙烯的结构简式为CH3CHCH2
③某有机物的名称是2,3-二甲基戊烷 ④![]() 与C8H6互为同分异构体
与C8H6互为同分异构体
A. ①②B. ②③C. ②④D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
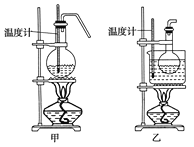
【题目】实验室制备1,2—二溴乙烷,可用足量的乙醇先制备乙烯,再用乙烯和少量的溴制备1,2—二溴乙烷,装置如图所示。有关数据列表如表所示。回答下列问题:
乙醇 | 1,2—二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是__。
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置A中除了浓硫酸和乙醇外,还应加入__,其目的是__。装置A中生成副产物乙醚的化学反应方程式为__。
(3)实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,为了验证SO2的存在并除去SO2对后续反应的干扰,某同学在A和D之间加入了B、C两个装置,其中B和C中可分别盛放___。
a.酸性KMnO4和水 b.品红和NaOH溶液
c.酸性KMnO4和NaOH溶液 d.品红和酸性KMnO4
(4)甲、乙两装置均可用作实验室由无水乙醇制取乙烯,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有无水乙醇和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点__,写出该实验中由无水乙醇制取乙烯的化学方程式___。
(5)将1,2—二溴乙烷粗产品置于分液漏斗中加水,振荡后静置后,产物应在__层;若产物中有少量副产物乙醚。可用__的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
(1)第一份加入![]() 溶液有沉淀产生
溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体![]()
(3)第三份加足量![]() 溶液后,得干燥沉淀
溶液后,得干燥沉淀![]() ,经足量盐酸洗涤、干燥后,沉淀质量为
,经足量盐酸洗涤、干燥后,沉淀质量为![]() 。根据上述实验,确定一定存在的离子是______;可能存在的离子是______;一定不存在的离子是______。
。根据上述实验,确定一定存在的离子是______;可能存在的离子是______;一定不存在的离子是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂制备三氯化六氨合钴(III)配合物(活性的二价钴氨配合物氧化为惰性的三价钴氨配合物)的流程如下:

已知:Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。

(一)三氯化六氨合钴(III)配合物的制备
(1)步骤②中要冷却至10℃再缓慢地边搅拌边加入H2O2溶液,这样操作的目的是:________。
(2)实验室制备三氯化六氮合钴(III)总反应化学方程式为:_______________________。
(3)实验操作1为______________。操作2在[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是____________________________________________。
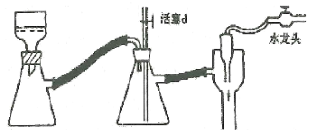
(4)实验中用到减压抽滤装置如图,当抽滤完毕或中途停止抽滤时,应当采取的正确操作过程是_________________。
(二)产品中NH3含量的测定
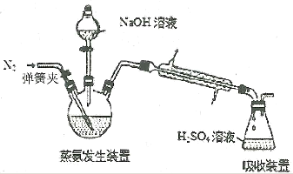
现称取0.1000g产品,在三颈烧瓶中发生如下反应:
[Co(NH3)x]Cl3+3NaOH=Co(OH)3↓+xNH3↑+3NaCl(见下图),锥形瓶中装有10.00mL c mol·L-1 H2SO4,加热烧瓶,使NH3完全逸出。滴加2滴指示剂,用0.5000mol·L-1 NaOH标准溶液滴定,滴定达到终点时消耗NaOH溶液V mL。
(5)下列关于实验的说法不正确的是______________。
A.第①步需在NH4Cl溶液中加入研细的CoCl2·6H2O晶体,目的是加速固体的溶解
B.原料NH4Cl的主要作用是抑制NH3·H2O的电离,有利于生成二价钴氨配合物,不形成Cu(OH)2
C.减压过滤涉及转移溶液,具体是:用倾析法先转移溶液,后开大水龙头,待溶液快流尽时再转移沉淀
D.第④步中使用含有盐酸的沸水,促进产品的析出
E.滴定时加入的2滴指示剂是酚酞
(6)根据实验(二)的数据计算:晶体中NH3的质量分数为__________(用含字母的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,将一盛有等体积NO、NO2的试管倒立在水槽中,充分反应后,下列叙述不正确的是(设试管中的溶质不往试管外扩散)
A.此反应中水既不是氧化剂又不是还原剂
B.试管内溶液中溶质的物质的量浓度为![]() mol/L
mol/L
C.溶液体积占试管容积的三分之二
D.若将试管中的气体换为氯化氢,则水充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com